Първият принцип на термодинамиката - ОСНОВИ НА ТЕРМОДИНАМИКАТА - МОЛЕКУЛНА ФИЗИКА И ТЕРМОДИНАМИКА - ФИЗИКА
7.4. Първият принцип на термодинамиката
Първият принцип на термодинамиката е общ закон за запазване и преобразуване на енергията, формулиран според процесите, в които участва топлината.
Първият принцип на термодинамиката може да се формулира по следния начин: топлината, предоставена на системата, се изразходва за увеличаване на нейната вътрешна енергия, както и за работа срещу външни сили.
Този принцип обобщава множество експерименти за създаване на „вечен двигател“. Първият проект на такъв двигател е известен още през 13 век. Но още през 1775 г. Френската академия на науките решава да не приема проекти за вечни двигатели за разглеждане. Първият принцип гласи: "perpetuum mobile" (от лат. perpetuum mobile - вечно подвижен) от първи вид е невъзможен. Perpetuum mobile от първи вид се разбира като такъв двигател, който, повтаряйки произволен брой пъти, един и същ процес, може да извърши много работа в сравнение с количеството енергия, което абсорбира отвън. С други думи, „perpetuum mobile” от първия вид е такъв двигател, който сам би генерирал енергия. Ако беше възможно да се построи „perpetuum mobile от първи вид, човечеството вече нямаше да се тревожи за гориво, чиято химическа енергия се преобразува в механична енергия в двигатели с вътрешно горене и парни двигатели, да строи язовири на реки за водноелектрически инсталации и др.
където En е потенциалната енергия на системата; Ek - кинетична енергия на системата; U е неговата вътрешна енергия. Да приемем, че няма взаимодействие на системата с външната среда, тогава En = 0. Ако системата е неподвижна спрямо външни тела, тогава Ek = 0.
Вътрешната енергия на системата се състои от кинетичната и потенциалната енергия на нейните съставни елементи:
Да приемем, че системата епроизволен кръгов процес, когато системата, претърпяла промени, се връща в самото си първоначално състояние, както е схематично изобразено на фиг. 7.4. Ще се промени ли енергията на системата в състояние B след кръговия процес ВаС b В? Въз основа на многовековен опит, обобщен в закона за запазване и трансформация на енергията, на този въпрос може да се отговори по следния начин: вътрешната енергия на една система в определено състояние е постоянна величина и не зависи от това как точно системата е стигнала до това състояние.
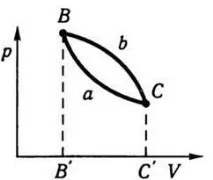
Ако системата, преминавайки от състояние B към състояние C, получава енергия U 1 поради взаимодействие със средата и след това, връщайки се в състояние B, дава енергия U 2 на средата, тогава тези енергии са равни една на друга: U 1 = U 2 . В противен случай би се оказало, че ако енергията се е появила от нищото или е изчезнала без следа, това би противоречило на закона за запазване и трансформация на енергията. От това следва важен извод: вътрешната енергия на термодинамичната система е еднозначна функция на състоянието, т.е. всяко състояние съответства на определена стойност на вътрешната енергия. Ясно е, че обратното твърдение - всяка стойност на вътрешната енергия съответства на определено състояние - е напълно погрешно, тъй като различни състояния могат да съответстват на определена стойност на вътрешната енергия. Енергията е мярка за движение. Движението е основно свойство на материята. Следователно увеличаването или намаляването на енергията на една система означава промяна в нейното движение в количествено и качествено отношение. Промяната в движението е придружена от промяна в свойствата на системата, нейното физическо състояние, което се характеризира с определени параметри. Предположението, че в едно и също състояние на системата енергията може да бъде различна по стойност, е еквивалентно на предположението, че движението не е свързано сматерия, но е нещо външно за нея. Това обаче противоречи на основите на материалистичната диалектика за неразривната връзка между материята и движението. Вътрешната енергия е недвусмислена функция на термодинамичното състояние. Вътрешната енергия на системата в състояния B и C (виж фиг. 7.4) се определя от състоянията на системата и не зависи от това как точно системата е преминала, например, от състояние B в C (BaC или B b C). Следователно промяната във вътрешната енергия на системата по време на прехода от едно състояние в друго не зависи от метода (пътя) на прехода; зависи само от началното и крайното състояние. Това е друга формулировка на първия принцип на термодинамиката.
Нека да преминем към неговата количествена формулировка. Помислете за термодинамична система, например газ в цилиндър с бутало, което се движи. В резултат на взаимодействие със средата енергията преминава към системата или, обратно, от системата към средата. Обменът на енергия може да се извърши само по два начина: в резултат на работа или нагряване. Тези два метода не се изключват взаимно и могат да работят едновременно: например, енергията на газ може да се увеличи чрез едновременно компресиране и нагряване. Ако тялото не получава никаква енергия отвън, тогава работата, която газът извършва по време на неговото разширяване, се извършва благодарение на вътрешната му енергия. Тази енергия U е сумата от кинетичната енергия на топлинното движение на молекулите и потенциалната енергия на тяхното взаимодействие.
Обаче промяната във вътрешната енергия на тялото по време на произволен процес, най-общо казано, не съвпада с извършената работа, тъй като тялото може също да получава (или отдава) енергия чрез директен преход от други тела. В този случай не се извършва механична работа. Получената по този начин енергия се нарича количество топлина. Ще разгледаме тази стойностположителна, ако тялото получава малко топлина, и отрицателна, ако я отдава.
Нека газът под буталото осигури количеството топлина Δ Q = Q 2 - Q 1 . Поради разширяването на газа, буталото ще се издигне до височина Δh. Ако налягането над буталото остане постоянно ( p \u003d const), тогава работата, която газът извършва, се определя от формулата
Въпреки това Δ Q ≠ Δ A, тъй като част от топлината, подадена към системата, се превръща във вътрешна енергия на газа DS/. Тогава е вярно следното равенство:
където Δ Q е количеството получена топлина; Δ A е работата, която се извършва; Δ U е промяната във вътрешната енергия на системата, когато тя се прехвърля от едно състояние в друго по време на нагряване. Съотношението (7.9) е количествен израз на закона за запазване на енергията по време на топлинни процеси, т.е. това е първият принцип на термодинамиката, който може да се формулира по следния начин: количеството топлина, предоставена на системата, се изразходва за увеличаване на вътрешната енергия и за извършване на работа върху външни тела от системата.
Да се върнем на фиг. 7.4. Нека системата, когато се нагрее, премине от състояние B в състояние C, първо от BaC, а след това от B - C. Работата, която системата ще извърши в този случай, ще се определя от площта, покрита от кривата BaC, ординатите BB' и CC' и оста на обема в първия случай, и площта, покрита от кривата BbC, ординатите BB' и CC' и оста на обемите - във втория случай. От фиг. Фигура 7.4 показва, че тези области са различни: по време на прехода от състояние B към състояние C от BaC системата извършва повече работа, отколкото по време на прехода от път B към C. Следователно работата, която системата извършва при преминаване от едно състояние в друго, зависи от пътя на прехода. Тъй като Δ U в уравнение (7.9) е постоянна стойност за дадено начално и крайно състояние, иТъй като количеството извършена работа не е постоянна стойност и зависи от пътя, очевидно е, че количеството топлина, което трябва да се отдаде на системата, за да се осъществи преходът, също зависи от пътя на прехода. Както следва от (7.9), за прехода от състояние B към състояние C през BaC системата трябва да получи по-голямо количество топлина, отколкото за прехода през B b C.
И така, както работата, извършена от системата, така и количеството топлина, което системата получава при преминаване от едно състояние в друго, зависят от пътя на прехода.
Съвсем ясно е, че горното разсъждение остава валидно дори когато системата отделя топлина по време на прехода или когато се извършва работа по системата.