Решение. Методът на валентните връзки (BC) не може да обясни редица свойства и структурата на някои молекули (парамагнетизъмO2 молекули; по-голяма здравина на връзката
Методът на валентните връзки (BC) не може да обясни редица свойства и структура на някои молекули (парамагнетизъм на молекулата O2; по-голяма сила на връзката в молекулните йони F и O, отколкото съответно в молекулите F2 и O2; напротив, по-ниската сила на връзката в йона N, отколкото в молекулата на N2; съществуването на молекулния йон He и нестабилността на молекулата He2 и др.). По-плодотворен беше друг подход за обяснение на ковалентната връзка - методът на молекулярните орбитали (МО). В метода MO състоянието на една молекула се описва като набор от електронни молекулни орбитали. Броят на молекулните орбитали е равен на сумата от атомните орбитали. Молекулярната орбитала, произтичаща от добавянето на атомни орбитали (AO), съответства на по-ниска енергия от първоначалните орбитали. Такава MO има повишена електронна плътност в пространството между ядрата, насърчава образуването на химична връзка и се нарича свързваща MO. Молекулярна орбитала, образувана чрез изваждане на атомни орбитали, има по-висока енергия от атомните орбитали. Електронната плътност в този случай е концентрирана зад ядрата на атомите, а между тях е равна на нула. Такива МО са енергийно по-неблагоприятни от първоначалните АО; те водят до отслабване на химичната връзка и се наричат антисвързващи МО. Електроните, заемащи свързващите и разхлабващите орбитали, се наричат съответно свързващи (sv) и разхлабващи (spar) електрони. Запълването на молекулните орбитали става в съответствие с принципа на Паули и правилото на Хунд, като тяхната енергия нараства в следната последователност:
На фиг. 1 показва енергийната схема за образуване на молекулни орбитали от атомни за двуатомни хомоядрени (от същия елемент) молекули на елементи от втория период. Броят на свързващите и разхлабващите електрони зависи от техния бройатоми на първоначалните елементи.
Трябва да се отбележи, че по време на образуването на B2, C2 и N2 молекули, енергията на свързващите σ2px-орбитали е по-голяма от енергията на свързващите π2py- и π2pz-орбитали, докато в O2 и F2 молекулите, напротив, енергията на свързване π2py - и π2pz-орбитали е по-голяма от енергията на свързващите σ2px-орбитали. Това трябва да се има предвид при изобразяването на енергийните схеми (фиг. 1) на съответните молекули.
Редът на връзкатав една молекула се определя от разликата между броя на свързващите и разхлабващите орбитали, разделена на две. Редът на връзката може да бъде нула (молекулата не съществува), цяло число или положително дробно число.
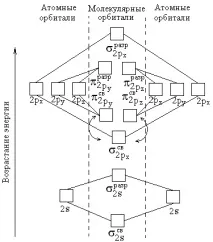
атомни за хомонуклеарни молекули от втория период
Подобно на електронните формули, показващи разпределението на електроните в атома в атомните орбитали, при МО метода се съставят формули на молекули, които отразяват тяхната електронна конфигурация. По аналогия с атомнитеs-, p-, d-, f-орбитали, молекулните орбитали се означават с гръцки букви σ, π, δ, φ.
Така електронната конфигурация на молекулите на O2 се описва, както следва:
Буквите KK показват, че четири 1s-електрона (два свързващи и два разхлабващи) нямат практически никакъв ефект върху химичната връзка.
Пример 4. Сярата образува химически връзки с калий, водород, бром и въглерод. Кои връзки са най-малко полярни? Посочете в посока на кой атом е изместена споделената електронна двойка?
Не намерихте това, което търсихте? Използвайте търсачката:
Деактивирайте adBlock! и обновете страницата (F5)наистина е необходимо