Структурата на калциевата АТФ-аза SERCA и механизмът на изпомпване на калций
• Подобно на Na+/K+-ATPase, реакционният цикъл за Ca 2+-ATPase включва две основни конформации
• Фосфорилирането на Ca 2+ -ATPase субединици води до конформационни промени и транслокация на Ca 2+ йони през мембраната
Клетъчната стимулация, която възниква под действието на хормони или електрически импулс, приложен към плазмената мембрана, се проявява във временно повишаване на концентрацията на Ca 2+ йони в цитозола, които регулират много вътреклетъчни процеси. Ca 2+ активира много клетъчни функции, от генна транскрипция и протеинов синтез до регулирана секреция на хормони, активиране на имунния отговор, клетъчна подвижност, невронално запалване и клетъчна контракция. Почти всички клетки са в състояние да ги освободят от вътреклетъчните депа, за да повишат бързо концентрацията на Ca 2+ йони в цитозола. Увеличаването на съдържанието на Ca 2+ в цитозола зависи от освобождаването му от ендоплазмения ретикулум (EPR).
Заедно с функционирането каточаст от секреторния механизъм, EPR функционира като депо на вътреклетъчен Ca 2+. В ендоплазмения ретикулум концентрацията на Са 2+ е около 10-3 М, а между него и цитозола, съдържащ 10-7 М Са 2+, има стръмен електрохимичен концентрационен градиент. След преминаване на калциевия сигнал в клетката отново се установява концентрацията на Ca 2+, която е характерна за състоянието на покой. Основният Ca 2+ -транспортен протеин, който осигурява освобождаването на Ca 2+ йони от цитозола, е Ca 2+ -ATPase, различни изоформи на която присъстват в ER и в плазмената мембрана.
В този раздел ще разгледаме еднаот основните Ca 2+ -ATPases, която се намира в мускулни клетки и неврони. Клетките на скелетните мускули имат специална структура на големи вътреклетъчниCa 2+ депа, които се наричат саркоплазмен ретикулум (СР). Тази структура е в състояние ефективно да контролира вътреклетъчното поемане на Ca 2+ и неговото освобождаване в цитозола.
Освобождаването на Ca 2+йони от цитозола на мускулните клетки се осигурява главно от Ca 2+ -ATPase (SERCA) на саркоплазмения ретикулум. Мускулните клетки са едни от най-големите клетки в тялото и за ефективно активиране и отпускане на контрактилните протеини в цялата клетка е необходима разклонена мрежа от структури, която осигурява вътреклетъчно освобождаване на Ca 2+ и неговата реабсорбция в депото.
SERCA-помпатае Ca 2+ -активирана АТФаза, която е член на голямо семейство от АТФ-зависими клетъчни помпи, известни като P-тип АТФази. Тези АТФази използват механизъм, чрез който енергията, освободена по време на хидролизата на АТФ, се използва за транспортиране на Н+, Na+ или Ca 2+ йони срещу концентрационен градиент. Характерна особеност на P-тип АТФазите е, че в присъствието на съответния катион те използват АТФ, за да фосфорилират остатъка от аспарагинова киселина, открит в структурата на тези ензими. Фосфорилирането води до междинен високоенергиен протеин, който се редува между свързване на Ca2+ и трансфер на фосфат по време на цикъла на помпата.
По този начинSERCA-помпатаизползва химическата енергия на хидролизата на АТФ за бързо намаляване на вътреклетъчната концентрация на Ca 2+, поради неговата реабсорбция в депотосаркоплазмен ретикулум (SR).
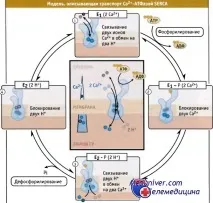
Фигурата по-долу показва очакванитестъпки на цикъла на SERCA помпа. Този цикъл се характеризира с две основни конформации на ензима: • E1 конформация, в която Ca 2+ се свързва с висок афинитет от цитоплазмената страна, и • E2 конформация, в която Ca 2+ се свързва с много по-нисък афинитет и следователно напуска местата на свързване в лумена на SR.
По време на всекиензимен цикъл, два Ca 2+йона се транспортират в лумена SR и се предполага, че протоните се транспортират в обратна посока. При свързване с висок афинитет на два Ca 2+ атома, разположени в цитозола, конформацията се променя до E1 (2Ca 2+). В тази конформация протеинът претърпява автофосфорилиране с образуването на междинен макроергичен протеин Е1
P(2Ca2+). Енергията на този фосфопротеин се изразходва за прехода към конформацията E2-P(2H+), която има по-нисък афинитет към Ca 2+ йони. В тази конформация навлизането на йони от цитозола е затворено, афинитетът към йони на Са2+ транспортните места е намален и изходът на йони в лумена на SR е отворен. В замяна на свързване с Н+, Ca 2+ йони влизат в депото на SR. След това фосфатната група се хидролизира и цикълът е завършен.
В обобщение,работният цикъл на SERCA помпатасе състои от последователни събития на фосфорилиране-дефосфорилиране, които транспортират два Ca 2+ йона срещу концентрационен градиент в SR в замяна на два H+ йона. В този случай една молекула АТФ се хидролизира.
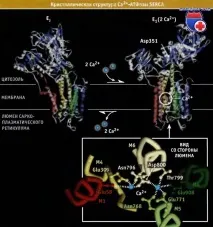
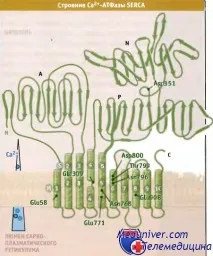
SERCA-pumpсе характеризира с асиметрично подреждане на трансмембранни и цитозолни домени, които се движат значително по време на транспортирането на Ca 2+ йони. Както е показано на фигурата по-долу, АТФ-азата се състои от 10 трансмембранни а-спирали (M1-M10) и две големи цитоплазмени бримки, разположени между трансмембранните спирали, с една бримка между М2 и М3, а другата между М4 и М5. Трансмембранните α-спирали образуват Са 2+ места за свързване, които в Е конформация кооперативно свързват два Са 2+ атома от цитозола. Две цитоплазмени бримки образуват три отделни домена. Примката между спиралите М4 и М3 образува нуклеотид-свързващ домен (N), който свързва АТФ, и Р-домен, който съдържа мястото на фосфорилиране. Примката между М2 и М3 съдържа домен (А), който е необходим за предаване на конформационни промени между трансмембранния и цитозолния домен.
Фигурата по-долу показвадве кристални структури, съответстващи на SERCA помпата в E2 (2H+) и E1 (2Ca 2+) конформации. Трансмембранните сегменти съдържат хидрофилни остатъци, които образуват транспортен път за Ca 2+ йони. Отварянето и затварянето на транспортния път изглежда е свързано с конформационни пренареждания на цитоплазмените домени, включващи S4 и S5 удължения на M4 и M5 трансмембранните сегменти. Структура, способна да свързва Ca 2+ с висок афинитет, се характеризира с наличието на широка празнина между цитозолните домени. Поради тази празнина АТФ се свързва с N-домена. Предполага се, че след като Ca 2+ йони са се свързали с трансмембранните домени и е възникнала E, (2Ca 2+ ) конформация, свързването на АТФ води до фосфорилиране на критичния остатък на аспарагинова киселина, Asp351, в P домейна. Това фосфорилиране индуцира преход към конформация Е2.с нисък афинитет към Ca 2+ .
В тазиконформация, пренареждането на трансмембранните домени унищожава Ca 2+ свързващите места, отваря SERCA помпата от страната на лумена и Ca 2+ йони се освобождават в лумена на саркоплазмения ретикулум. По време на обратния преход от E2 (2H+) към E1 (2Ca 2+) конформация се получава значително изместване на цитозолните домени и се образува отворена структура от компактна структура. Водните молекули влизат в отворена структура и осигуряват процеса на дефосфорилиране, което е важна стъпка за връщане на SERCA помпата в конформационно състояние, в което тя е в състояние да свързва Ca 2+ йони. Са 2+ местата за свързване са достъпни за цитоплазмения Са 2+, но не и за йони, съдържащи лумена, тъй като афинитетът на помпата към калция се променя по време на цикъла.
Тъй катоза спиране на процесана мускулна контракция и започване на нейното отпускане е необходимо намаляване на вътреклетъчната концентрация на Ca 2+, необходимо е потокът Ca 2+ през SERCA да бъде насочен само от цитозола към депото SR, а не обратното. Посоката на потока от йони през Ca 2+ -ATPase се определя от последователното конюгиране на събитията на АТФ хидролиза и целевия транспорт на Ca 2+. Конформационните промени в A, N и P домените, настъпващи при свързване и фосфорилиране на АТФ, причиняват разтягане на трансмембранните спирали, блокирайки пътя на Ca 2+ йона от страната на цитоплазмата. Когато фосфатната група се прехвърли, калциевата врата се затваря. По този начин при физиологични условия няма обратен поток на Ca 2+ йони от SR в цитозола.
Заизнос на Ca 2+йони от цитозола и поддържане на необходимото ниво на тези йони в него в покой, помпата SERCA работи съвместно с Ca 2+ -ATPase на плазмената мембрана (PCMA). И двата ензимаимат висок афинитет към Ca 2+ йони, който значително надвишава афинитета към този катион на други калций-свързващи протеини и буферни системи на цитозола. Помпите PCMA и SERCA имат сходна структура и подобен механизъм на действие. Те съдържат десет трансмембранни последователности и три големи домена в цитозола. Наред с различната локализация в клетката, PMCA помпата се различава от SERCA по това, че транспортира един, а не два Ca 2+ йона на една ATP молекула. Високата транспортна ефективност и високата плътност на помпата SERCA в SR мембраните на възбудимите клетки обяснява преобладаващото й участие в екскрецията на Ca2+ от цитозола.
Na+/K+-ATPaseиH+-ATPase, които също принадлежат към семейството на P-тип ATPase, споделят редица структурни характеристики с SERCA групата. Хомоложното сходство между Na+/K+ АТФаза и Ca2+ АТФаза е по-изразено, отколкото при други АТФази, и сравнението на техните структурни характеристики подкрепя мнението, че тези ензими имат общи механизми на свързване на АТФ хидролиза и катионен транспорт през мембраната. И трите катионни помпи използват един и същ каталитичен цикъл, който включва свързване на АТФ, конформационни пренареждания, водещи до улавяне на транспортирани катиони, тяхното освобождаване от другата страна на мембраната и дефосфорилиране, за да се върне ензимът към първоначалната му конформация, способна да свързва йони.