Светът на дивата природа на - Цитологични новини
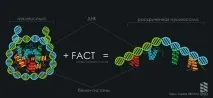
Флуоресцентни етикети се въвеждат в съседни навивки на нуклеозомна ДНК, едната от които служи като енергиен донор, а другата като акцептор. Донорът може да бъде възбуден с помощта на лазер с определена дължина на вълната. Ако донорът е близо до акцептора, тогава има пренос на енергия към акцептора. Колкото по-близо са етикетите, толкова по-ярък е сигналът от акцептора. По този начин е възможно да се следи разстоянието между съседни навивки на ДНК и да се прецени колко компактно е сгъната нуклеозомата. Методът е разработен от български учени.
С използването му учените показаха за първи път способността на нуклеозомите да се развиват обратимо под въздействието на FACT in vitro (in vitro), без да консумират енергия, което е доста необичайно, тъй като АТФ-зависимите ремоделиращи комплекси изразходват много енергия, за да пренаредят хроматина. По време на образуването на комплекса "нуклеозома-FACT" нишките на ДНК почти напълно се изправят, но остават свързани с хистонови протеини. Ако FACT се премахне от комплекса, тогава всичко се връща към нормалното: нуклеозомната ДНК отново се навива около основата на хистоните.По този начин FACT е рядък пример за ATP-независим (без естествени енергийни източници) комплекс за ремоделиране на хроматин.
Изследването на този протеинов комплекс е важно не само от научна, но и от медицинска гледна точка: FACT се намира в големи количества в туморните тъкани.
Червеите без очи са вкусили светлината
Работейки с червеи без очи, учените са открили принципно нов вид протеин, който възприема светлина. Той принадлежи към същия клас като вкусовите пъпки и работи с два порядъка по-ефективно от обикновения визуален пигмент.
Досега са известни само два вида фоторецептори при животните: криптохроми и опсини, последните от които работят в ретината на хора и други гръбначни. Авторите на статията откриха в червеите нематоди друг, принципно нов тип съединения, способни да реагират на светлина.
Учените подозираха съществуването му, като наблюдаваха как тези малки същества усърдно избягват проблясъци на светлина, въпреки липсата на очи. Оказа се, че нематодите имат протеин LITE-1, който е чувствителен към ултравиолетова светлина, но в същото време е подреден по същия начин като мембранните вкусови рецептори.
Обичайните зрителни пигменти на животните се състоят от две части - структурен протеин и хромофор, отговорен за абсорбцията на фотони (при хората ролята на витамин А играе). Дори ако конфигурацията на протеина е нарушена, хромофорът частично запазва своите абсорбиращи функции. Напротив, ако дори малко промените структурата на LITE-1, той напълно спира да абсорбира светлина. Следователно този протеин работи по съвсем различен начин.
Местоположението на аминокиселината триптофан изглежда е ключов фактор за работата на LITE-1. Изследователите добавиха тази аминокиселина към вкусовите рецептори от същото семействоGUR-3, както и LITE-1, и в резултат на това също започнаха да реагират на светлина. Това доказва, че в бъдеще биоинженерите ще могат изкуствено да създават нови видове фоторецептори.
Интересното е, че LITE-1 абсорбира UV 10-100 пъти по-ефективно от конвенционалните визуални пигменти. Поради това може да се използва за защита от слънчева светлина, както и в биологични изследвания. Например, с помощта на LITE-1 ще бъде възможно да се направят онези клетки, които преди това не са реагирали на ултравиолетова светлина, и след това произволно да се активират със светлинни лъчи.
Как ДНК е опакована в клетъчното ядро
Този подход доведе до неочаквани заключения. Първо, "работещият" хроматин, противно на традиционните идеи, както се оказа, запазва много висока степен на опаковане, тъй като е представен от силно структурирани хроматинови фибрили от по-висок порядък - хромонеми. Второ, оказа се, че ДНК в състава на хромонемите има висока структурна пластичност, т.е. тя може, така да се каже, да „тече“ от една част на хромонемата към друга. В същото време общата плътна структура на хромонемата не се променя. Тези наблюдения не се вписват в рамките на съществуващите теории за пространствената организация на хромозомите, но в същото време ни позволяват да формулираме нови хипотези за механизмите на предаване на епигенетична информация по време на клетъчното делене.
„Ние направихме предположение, че в нова дъщерна клетка хроматиновите структури могат да се движат вътре в нея, а не да бъдат фиксирани, взаимодействайки с ДНК, която все още не се е дублирала и „помни всичко“, а също така съдържа необходимите молекулярни компоненти за възстановяване на изгубената епигенетична информация“, обяснява Игор Киреев.
Учените също показаха, че структурната организация на генома не е такавае твърда йерархия: има определени принципи на изграждане, но в дадените граници ДНК има известна свобода и пластичност.
В бъдеще изследователите се надяват да се доближат до дешифрирането на принципите на пространствената организация на ДНК, използвайки директни методи за анализ, използвайки визуализация с висока разделителна способност на модели на опаковане на хроматин. От практическа гледна точка, разбирането на структурните аспекти на епигенетичния контрол на генната експресия ще помогне да се намерят начини за регулирането му, което ще позволи разработването на по-ефективни подходи за терапевтични интервенции.
Синтезът на протеини в митохондриите може да се случи без ключов компонент
Митохондриите - органели, "енергийните станции" на нашите клетки - теоретично трябва да синтезират протеини като прокариотите. Факт е, че според теорията, която сега преобладава в науката, митохондриите някога са били независими едноклетъчни безядрени организми, като бактерии, които нашите отново едноклетъчни, но вече еукариотни предци са „погълнали“, но вместо да бъдат усвоени, са ги поставили на тяхна служба. В резултат на това митохондриите запазват много характеристики на независими организми: собствена ДНК идори техните рибозоми, в които също се осъществява протеинов синтез.
Преди това бяха открити три протеина на транслационния фактор в митохондриите: mtIF1, mtIF2 и mtIF3. Изглежда, че всичко "мина по план", напълно в съответствие с теорията. Експеримент на учени от Московския университет, който имаше за цел да докаже, че факторът mtIF3 (идентифициран по-късно от други) е също толкова необходим за протеиновия синтез, колкото и първите два, даде неочакван резултат.
Молекулярните биолози „изрязват“ гена, кодиращ протеина mtIF3, от митохондриалната ДНК на хлебната мая и на негово място вмъкват гена за резистентност към антибиотик, добавен към хранителната среда, така че всички клетки, в които генът е останал, са убити. За изненада на учените митохондриите на оцелелите клетки, които нямат трети транслационен фактор, продължават успешно да синтезират протеини.
Най-вероятно учените сега предполагат, че mtIF3 има и други функции в клетката - той координира съотношението на протеините, произведени в митохондриите. Тъй като връзката между нарушението на такава координация и развитието на болестта на Паркинсон беше установена по-рано, това откритие може да помогне за по-доброто разбиране на механизмите на това заболяване и разработването на нови методи за неговото лечение.
В допълнение, откритието на учени от Московския държавен университет отваря пътя към по-точно моделиране на митохондриалната транслационна система in vitro („ин витро“). Такива модели, разработени за еукариотни и бактериални клетки, помагат на учените да тестват лекарства (включително нови антибиотици) и да извършват други важни експерименти от известно време.