Топлинна мощност на идеален газ
Ако в резултат на топлообмен на тялото се предаде определено количество топлина, тогава вътрешната енергия на тялото и неговата температура се променят. Количеството топлина Q, необходимо за нагряване на 1 kg вещество с 1 K, се нарича специфична топлина на веществото c.
| c = Q / (mΔT). |
В много случаи е удобно да се използва моларният топлинен капацитет C:
| C = M c, |
където М е моларната маса на веществото.
Определеният по този начин топлинен капацитет не е еднозначна характеристика на дадено вещество. Според първия закон на термодинамиката промяната във вътрешната енергия на тялото зависи не само от количеството получена топлина, но и от работата, извършена от тялото. В зависимост от условията, при които се извършва процесът на пренос на топлина, тялото може да извършва различни дейности. Следователно едно и също количество топлина, предадено на тялото, може да причини различни промени във вътрешната му енергия и, следователно, температурата.
Такава неяснота при определяне на топлинния капацитет е характерна само за газообразно вещество. При нагряване на течни и твърди тела техният обем практически не се променя и работата на разширението се оказва равна на нула. Следователно цялото количество топлина, получено от тялото, отива за промяна на вътрешната му енергия. За разлика от течностите и твърдите вещества, газът в процеса на пренос на топлина може значително да промени обема си и да извърши работа. Следователно топлинният капацитет на газообразното вещество зависи от характера на термодинамичния процес. Обикновено се разглеждат две стойности на топлинния капацитет на газовете: CV е моларният топлинен капацитет визохоричен процес (V = const) и Cp е моларният топлинен капацитет в изобарния процес (p = const).
В процеса при постоянен обем газът не работи: A \u003d 0. От първия закон на термодинамиката за 1 мол газ следва
| QV = CV ∆T = ∆U. |
Промяната ΔU на вътрешната енергия на газ е правопропорционална на промяната ΔT на неговата температура.
За процес при постоянно налягане първият закон на термодинамиката дава:
| Qp = ΔU + p (V2 – V1) = CV ΔT + pΔV, |
където ΔV е промяната в обема на 1 мол идеален газ, когато температурата му се промени с ΔT. Това предполага:
Съотношението ΔV / ΔT може да се намери от уравнението на състоянието на идеалния газ, написано за 1 мол:
| pV=RT, |
където R е универсалната газова константа. За p = const
| или |
По този начин връзката, изразяваща връзката между моларните топлинни мощности Cp и CV има формата (формула на Майер):
| Cp = CV + R. |
Моларният топлинен капацитет Cp на газ при процес с постоянно налягане винаги е по-голям от моларния топлинен капацитет CV при процес с постоянен обем (Фигура 3.10.1).
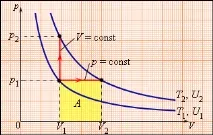 |
| Фигура 3.10.1. Два възможни процеса на нагряване на газ чрез ΔT = T2 – T1. При p = const газът извършва работа A = p1(V2 – V1). Следователно Cp > CV |
Съотношението на топлинните мощности при процеси с постоянно налягане и постоянен обем играе важна роля в термодинамиката. Означава се с гръцката буква γ.
По-специално, това съотношение е включено във формулата за адиабатен процес (виж §3.9).
Между две изотерми с температури T1 и T2 на (p, V) диаграмата са възможни различни преходни пътища. Тъй като за всички такива преходи промяната в температурата ΔT = T2 – T1 е една и съща, следователно промяната ΔU на вътрешната енергия е една и съща. Работата A, извършена в този случай, и количеството топлина Q, получено в резултат на преноса на топлина, ще бъдат различни за различните преходни пътища. От това следва, че един газ има безкраен брой топлинни мощности. Cp и CV са само частични (и много важни за газовата теория) стойности на топлинните мощности.
 |
| Модел. Топлинни мощности на идеален газ |
Термодинамичните процеси, при които топлинният капацитет на газа остава непроменен, се наричат политропни. Всички изопроцеси са политропни. В случай на изотермичен процес ΔT = 0, така че CT = ∞. При адиабатен процес ΔQ = 0, следователно Cad = 0.
Трябва да се отбележи, че "топлинен капацитет", както и "количество топлина" са изключително неудачни термини. Те са наследени от съвременната наука от теорията за калориите, преобладаваща през 18 век. Тази теория разглежда топлината като специална безтегловна субстанция, съдържаща се в телата. Смятало се, че не може нито да бъде създадено, нито унищожено. Нагряването на телата се обяснявало с увеличаване, а охлаждането - с намаляване на съдържащата се в тях калория. Калорийната теория е несъстоятелна. Не може да се обясни защо същата промяна във вътрешната енергия на едно тяло може да се получи чрез предаване на различно количество топлина в зависимост от извършената от тялото работа. Следователно твърдението, че "дадено тяло съдържа такъв и такъв запас от топлина", е лишено от физически смисъл.
В молекулярно-кинетичната теория се установява следната връзка между средната кинетична енергиятранслационно движение на молекули и абсолютна температура T:
Вътрешната енергия на 1 мол идеален газ е равна на произведението на числото на Авогадро NA:
Когато температурата се промени с ΔT, вътрешната енергия се променя с количеството
Коефициентът на пропорционалност между ΔU и ΔT е равен на топлинния капацитет CV при постоянно налягане:
Тази връзка е добре потвърдена в експерименти с газове, състоящи се от едноатомни молекули (хелий, неон, аргон). Въпреки това, за двуатомни (водород, азот) и многоатомни (въглероден диоксид) газове това съотношение не е в съответствие с експерименталните данни. Причината за това несъответствие е, че за дву- и многоатомните молекули средната кинетична енергия трябва да включва енергията не само на транслационното, но и на въртеливото движение на молекулите.
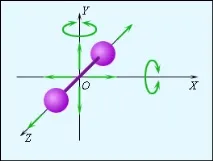 |
| Фигура 3.10.2. Модел на двуатомна молекула. Точка O съвпада с центъра на масата на молекулата |
На фиг. 3.10.2 показва модел на двуатомна молекула. Една молекула може да извърши пет независими движения: три транслационни движения по осите X, Y, Z и две завъртания около осите X и Y. Опитът показва, че въртенето около оста Z, върху която лежат центровете на двата атома, може да бъде инициирано само при много високи температури. При обикновени температури въртене около оста Z не се случва, точно както едноатомната молекула не се върти. Всяко независимо движение се нарича степен на свобода. Така едноатомната молекула има 3 транслационни степени на свобода, "твърдата" двуатомна молекула има 5 степени (3 транслационни и 2 ротационни) имногоатомна молекула - 6 степени на свобода (3 транслационни и 3 ротационни).
В класическата статистическа физика се доказва така наречената теорема за равномерното разпределение на енергията по степени на свобода:
Ако системата от молекули е в термично равновесие при температура T, тогава средната кинетична енергия е равномерно разпределена между всички степени на свобода и за всяка степен на свобода на молекулата е равна на
От тази теорема следва, че моларните топлинни мощности Cp и CV на газа и тяхното съотношение γ могат да бъдат записани като
където i е броят на степените на свобода на газа.
За газ, състоящ се от едноатомни молекули (i = 3)
За газ, състоящ се от двуатомни молекули (i = 5)
За газ, състоящ се от многоатомни молекули (i = 6)
Експериментално измерените топлинни мощности на много газове при нормални условия са в добро съответствие с горните изрази. Като цяло обаче класическата теория за топлинния капацитет на газовете не може да се счита за напълно задоволителна. Има много примери за значителни несъответствия между теория и експеримент. Това се обяснява с факта, че класическата теория не е в състояние напълно да отчете енергията, свързана с вътрешните движения в молекулата.
Теоремата за равномерното разпределение на енергията по степени на свобода може да се приложи и към топлинното движение на частиците в твърдо тяло. Атомите, които изграждат кристалната решетка, вибрират около равновесните позиции. Енергията на тези вибрации е вътрешната енергия на твърдото тяло. Всеки атом в кристалрешетката може да се колебае в три взаимно перпендикулярни посоки. Следователно всеки атом има 3 вибрационни степени на свобода. При хармоничните вибрации средната кинетична енергия е равна на средната потенциална енергия. Следователно, в съответствие с теоремата за равномерното разпределение, всяка вибрационна степен на свобода има средна енергия kT и 3kT на атом. Вътрешната енергия на 1 мол твърдо вещество е:
| U = 3NAkT = 3RT. |
Следователно моларният топлинен капацитет на вещество в твърдо състояние е равен на:
| C \u003d 3R \u003d 25,12 J / mol K. |
Тази зависимост се нарича закон на Дюлонг-Пети. За твърдите тела практически няма разлика между Cp и CV поради незначителната работа, извършена при разширяване или свиване.
Опитът показва, че за много твърди вещества (химични елементи) моларният топлинен капацитет при обикновени температури наистина е близо до 3R. Въпреки това, при ниски температури има значителни несъответствия между теорията и експеримента. Това показва, че хипотезата за равномерно разпределение на енергията по степени на свобода е приближение. Експериментално наблюдаваната зависимост на топлинния капацитет от температурата може да се обясни само въз основа на квантовите концепции.
Не намерихте това, което търсихте? Използвайте търсачката: