Валентност на флуора, химични свойства, характеристики
Къде се намира флуорът в периодичната таблица? Валентността на този елемент е една, следователно, той е типичен представител на седмата група на основната подгрупа. Нека дадем кратко описание на този неметал, да разкрием неговите основни физични и химични свойства.
Страници с история
Помислете за структурата на флуорния атом, но първо нека се спрем на историята на неговото откриване. В началото на шестнадесети век немският лекар и минералог Грегори Агрикола описва минерал, който съдържа флуор. По това време валентността на елемента все още не беше известна, така че беше трудно да се предвидят основните му свойства.
В края на осемнадесети век шведският химик Карл Шееле успява да синтезира флуороводородно съединение чрез нагряване на концентрирана сярна киселина и флуоров шпат в стъклен съд. Веществото, получено от учения, не взаимодейства с метали, така че Шееле заключава, че химическата активност на флуороводородна киселина е незначителна.
В безводна форма той е получен едва в началото на деветнадесети век, но никой не успява да изолира чист флуор от съединението. Валентността на този неметал отдавна остава истинска загадка за химиците.
Едва през 1886 г. Moissan успява да изолира чист флуор чрез електролиза на воден разтвор на калциев хидрофлуорид. Той никога не е определял валентността на неметал, но за своите изследвания е удостоен с Нобелова награда за химия (1906 г.).
Поради токсичните свойства, идентифицирани в този химичен елемент, изследването му беше доста продължително. Едва след Втората световна война флуорът започва да се получава чрез промишлена обработка на флуориди.
Да бъдеш сред природата
флуорна молекулане се среща в природата в чист вид. Сред най-често срещаните флуорни съединения отбелязваме флуорипат. Флуоритът е бил използван в продължение на няколко века като почистващ компонент в металургичното производство. Изследователите са успели да установят, че минералът, използван за освобождаване на флуор, има свойството флуоресценция, тоест способността да дава синкав цвят при допълнително осветление.
Формулата на флуора е определена много по-късно, причината е ниското му разпространение в земната кора (не повече от 0,065 процента). Като основни съединения могат да се считат топаз, криолит и лепидолит.

Характеристики на имота
Този неметал при нормални условия е бледожълт газ с дразнеща миризма. Вдишването на флуор е опасно за хората, поради което толкова дълго време няма надеждна информация за физическите характеристики на този халоген. По време на изследването е идентифициран един стабилен изотоп на този елемент, който има формата - флуор-19. Специфичната структура на флуорния атом обяснява способността му да поставя стабилни комплекси около атома. Например, идентифицирани са хексафлуоросиликати и хексафлуороалуминати, като флуорът проявява своите силни окислителни свойства.
Никой друг неметал, намиращ се в периодичната таблица, няма такава способност да образува аниони. Поради тази причина флуорът не се среща в природата в чист вид. Едва в края на ХХ век американският химик Карл Крист успява да получи флуор. За да направи това, той извърши електролиза на разтвор на антимонов пентафлуорид.
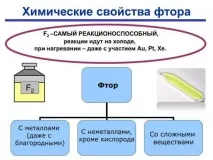
Химичните свойства на флуора се основават на способността му да приема електрон от други елементи. Имайки седем валентни електрона на външно ниво, той проявява състояние на окисление-1.
Основните химични свойства на флуора могат да се обяснят със структурните характеристики на неговия атом. Този елемент няма свободна d-орбитала, като хлора, така че не се характеризира с положителни степени на окисление.
Поради високата окислителна способност на този елемент, той образува съединения, които не са характерни за други халогениди: кобалтов трифлуорид, сребърен дифлуорид, рениев хептафлуорид, йоден хептафлуорид.

Типични връзки
По-голямата част от флуора е под формата на различни съединения с практическо значение. Например флуоровъглеродните масла се считат за оптимални смазочни материали. Флуорът лесно взаимодейства с дърво, каучук, тъкани, което намира приложение при флуорирането на органични вещества. В този случай е важно да вземете предпазни мерки, за да не усетите токсичните ефекти на този елемент.
производство
Производството на флуор се основава на обработката на флуорипат. Производството на флуороводород се придружава от дестилация на прахообразен флуорит с концентрирана сярна киселина. Този процес се извършва в чугунен или оловен апарат. След дестилация се образува калциев сулфат, който не може да се разтвори във флуороводород. За получаване на HF се използва фракционна дестилация в стоманени или медни съдове. Флуороводородът се съхранява в стоманени резервоари.
Като основни примеси, съдържащи се в това съединение, отбелязваме сярна, сярна и флуоросилициева киселина. Те се образуват поради наличието на силициев диоксид във флуорипат. За да се отстранят следите от влага от реакционната смес, се извършва електролиза върху платинени електроди. Готовата флуорна формула се съхранява върху силна киселина на Люис, способна да образува соли.

Търсене на HF
ФлуорВодородът е търсен при производството на различни органични и неорганични флуорни съединения. Например с негова помощ се образува Na3AlF6, който се използва като електролит в процеса на топене на алуминий. Флуороводородната киселина, която е разтвор на HF, е необходима в големи количества за почистване и полиране на метали. Придава на стъклото матов цвят, необходимо е за ецване.
Чистият флуор може да се поставя само в стоманени бутилки под налягане, ако няма органични вещества върху клапаните.

Разглежданият химичен елемент се използва при производството на различни флуориди, например кобалтов трифлуорид, серен хексафлуорид. Именно тези съединения се търсят като флуориращи агенти на органични вещества. Серният хексафлуорид е намерил приложение като газообразен диелектрик.
Елементарният флуор, смесен с азот, може да реагира с въглеводороди. Като реакционен продукт се образува определен флуоровъглерод, където водородът е напълно или частично заменен с халоген. Получените съединения се характеризират с висока стабилност, отлична електрическа устойчивост и химическа инертност.

Характеристики на флуорирането
Този процес може да се извърши чрез третиране на органичното съединение с кобалтов трифлуорид, както и чрез електролиза на неговия воден разтвор. Добре познатият на българските домакини тефлон е известен в химията като политетрафлуоретилен, получен чрез халогениране на ненаситени въглеводороди.
Климатиците и хладилниците използват специален хладилен агент (дихлородифлуорометан). Поради факта, че такива реагенти имаха отрицателно въздействие върху атмосферата, допринесоха за изчерпването на озоновия слой, тяхното производство постепенно беше ограничено. Сега са смененихладилни агенти, съдържащи флуоровъглеводороди.

Заключение
Флуорът проявява най-силни окислителни свойства от всички представители на халогенната подгрупа. Той има малък атомен радиус, което означава, че е много по-лесно за него да приеме един електрон, така че флуорът се използва за производството на флуориди.
Например, урановият хексафлуорид се използва в газодифузионния процес на отделяне на уран-235 от 238, който е типичен за производството на ядрено гориво. Борен трифлуорид и флуороводород се произвеждат в големи количества, тъй като тези компоненти са отлични катализатори за алкилиране, те са търсени при производството на органични съединения. Например, чрез добавяне на натриев флуорид към питейната вода, случаите на кариес могат да бъдат намалени.
Благодарение на съвременните методи за качествен и количествен анализ, широко използвани в аналитичната химия, стана възможно използването на различни флуорни съединения. Именно този представител на халогенната подгрупа е един от най-търсените елементи в органичната и неорганичната химия.