Видове органични киселини
Способността на органичните съединения да се йонизират варира в широки граници. Във воден разтвор е експериментално възможно да се определи pKa само до стойности от -15 (pKa на водата е 15,7). За по-слаби киселини pKa се определя в други разтворители. Например, в течен амоняк, pKa може да се определи до стойност 33. Киселинността във водата и амоняка може да бъде корелирана чрез определяне на pKa за всяко съединение паралелно в тези две среди, което позволява прехода от една скала към друга. Предложен е подход за оценка на киселинността на много слаби СН-киселини - полярографска скала за киселинност. Тази скала обхваща киселини, в които киселинността варира в рамките на 50 порядъка. Въпреки това стойностите на pKa, получени за слаби CH-киселини, са много приблизителни.
С оглед на изключително големия брой органични съединения е невъзможно всяко от тях да има количествена оценка на киселинните свойства. Наистина, pKa константите в различни разтворители са установени за сравнително малък брой съединения и са неизвестни за много дори важни биологично активни вещества. Следователно, качествен подход за оценка на киселинните свойства на различни киселинни центрове, който се основава наоценка на стабилността на спрегнатата основа : (!) Силата на една киселина се определя от стабилността на конюгираната основа (анион), образувана от тази киселина, е от голямо значение. Колкото по-стабилен е анионът, толкова по-силна е киселината.
С други думи, киселинността зависи от комбинация от редица фактори, които определят стабилността на анион А -:
• електроотрицателност и поляризуемост на елемента, отделящ протон;
• степента на делокализация на отрицателния заряд в аниона;
• възможностианион до солватация, т.е. взаимодействие с молекули на разтворителя.
Обикновено киселинността на повечето вещества в разтвора се влияе едновременно от няколко фактора, но във всеки случай един или повече от тях ще бъдат преобладаващи. По-долу ще разгледаме ролята на тези фактори при определяне на стабилността на анионите (първоначално, без да отчитаме влиянието на средата). При липса на ефекти на солватация се проявява истинската (присъща) киселинност на съединението. Присъщата киселинност се появява в газовата фаза, като в този случай тя се определя единствено от структурата на съединението.
Природата на атома в киселинния център. Ролята на електроотрицателността и поляризуемостта на даден елемент в киселинния център може ясно да се демонстрира чрез примера на киселини на Брьонстед с различни киселинни центрове, но със същите заместители, в този случай етилови радикали:
Чрезповишаване на киселинността киселини на Brønsted:
Стабилността на съответните аниони нараства в същия ред.Колкото по-електроотрицателен е елементът в киселинния център, толкова по-способен е той да носи отрицателен заряд и съответноколкото по-стабилен ще бъде образуваният анион.
Тъй като електроотрицателността на кислородния атом (3.5) е по-голяма от тази на азотния атом (3.0) и въглеродния атом (2.5), стабилността на съответните аниони ще намалее в същия ред. Сравняваните елементи са в един и същи период и поляризуемостта им е почти еднаква. За елементите от третия и следващите периоди на периодичната система основното влияние върху стабилността на аниона се оказва откоефициента на поляризуемост. В горната група киселини на Брьонстед, в случая на етантиол а, серният атом е по-голям и по-лесно поляризиран от елементитевторият период (O, N, C) за други киселини. Отрицателният заряд на серния атом е делокализиран в по-голяма степен. Следователно алканетиолатният йон е по-стабилен от съответния алкоксиден йон и т.н. Като цяло SH-киселината ще бъде по-силна от OH-, NH- и CH-киселините. За представената проба от съединения, киселинността в газовата фаза и в разтвора ще бъде една и съща поради факта, че солватацията на аниони с подобни размери ще бъде изравнена. Тиолите, като по-силни киселини, реагират с алкали, както и с оксиди, хидроксиди и соли на тежки метали. Тиолите образуват водоразтворими соли с алкални метали и неразтворими соли с тежки метали:
Способността на тиолите да свързват йони на тежки метали доведе до използването им като антидот при отравяне със съединения на арсен, живак, хром, бисмут и други метали, свързани с тиоловите отрови.
Етиламинът и пропанът не показват забележими киселинни свойства. Независимо от това, в други NH- и CH- киселинните свойства са много по-изразени, което се дължи на ефекта на изтегляне на електрони на заместителите, свързани с киселинния център.
Анионна стабилизация поради конюгация. При сравнителна оценка на киселинността на съединения, които имат един и същ елемент в киселинния център, основният фактор, определящ собствената им киселинност, е делокализацията на отрицателния заряд в аниона. Стабилността на аниона се увеличава значително, ако е възможно да се делокализира отрицателният заряд по протежение на системата от спрегнати връзки. Характерен пример за проявата на действието на този фактор в групата на ОН-киселините е повишаването на киселинността при прехода от алкохоли към феноли и карбоксилни киселини.
Увеличаването на киселинността на фенолите в сравнение с алифатните алкохоли се обяснява с по-голямата стабилност на феноксидния йон, в койтоотрицателният заряд се делокализира с участието на въглеродни атоми на бензеновия пръстен:
Повишената киселинност на карбоксилните киселини в сравнение с фенолите се дължи на стабилизирането на ацилатните йони, при които отрицателният заряд, дължащ се на p, π конюгацията, се разпределя равномерно между два кислородни атома:
Делокализацията на отрицателния заряд по системата от спрегнати връзки, водеща до стабилизиране на аниона, води до повишаване на киселинността и на други видове киселини.
Влияние на електронните ефекти на заместителите, свързани с киселинния център. Независимо от механизма на предаване на електронното влияние на заместителя (индуктивен или мезомерен), в общия случай е вярно следното правило: (!) Заместителите, които отнемат електрони, допринасят за делокализацията на отрицателния заряд, стабилизират аниона и по този начин повишават киселинността. Електронодонорните заместители, напротив, го понижават. Ефектът на халогенните атоми, изтеглящи електрони, върху киселинността е ясно илюстриран от стойностите на pKa на моно- и трихалоген-заместени оцетни киселини. Флуорът, най-електроотрицателният елемент, има най-силен ефект:
Влиянието на заместителите е особено силно изразено в серията от заместени феноли. Електрон-оттеглящата нитро група, например, допълнително стабилизира получения анион, което води до повишаване на киселинността на р-нитрофенола (pKa 7.1) в сравнение с незаместения фенол (pKa 10). Наличието на три нитро групи в бензеновия пръстен води до факта, че 2,4,6-тринитрофенол (пикринова киселина) вече се превръща в много силна киселина (pKa 0,8), сравнима с минералните киселини. Донорните на електрони метилови и аминогрупи дестабилизират феноксидните йони и намаляват киселинността на n-метилфенола (pKa 10.1) и n-аминофенола (pKa 10.5):
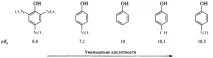
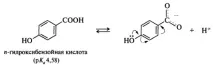
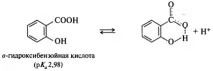
в ароматни киселинивлиянието на заместителите, разположени в мета- и пара-позициите на бензеновия пръстен, се подчинява на общото правило: изтегляне на електрони - повишаване на киселинността, отдаване на електрони - намаляване. Поведението на орто-заместените киселини често е необичайно. По правило орто-заместените бензоени киселини са по-силни от съответните пара-изомери, независимо дали заместителят е донор или акцептор. Това влияние на заместителя се нарича орто ефект. Понякога орто ефектът има много очевидно обяснение. Например, n-хидроксибензоената киселина (pKa 4,58) е по-слаба от бензоената киселина (pKa 4,19), както се очаква от ефекта на електрон-донорната OH група върху киселинността. Салициловата (о-хидроксибензоена) киселина обаче е много по-силна (pKa 2,98), тъй като вътремолекулната водородна връзка допринася за стабилизирането на салицилатния йон, образуван от тази киселина, което води до повишаване на киселинността на този конкретен изомер:
солватационен ефект. Ефектът от солватацията може да бъде много значителен. В почти всички случаи на киселинно-алкални взаимодействия може да се предположи, че първоначалните неутрални молекули и получените йони се солватират по различен начин. Стабилността на един анион по същество зависи от неговата солватация в разтвор. Взаимодействието между разтворителя и йона може да бъде различно по природа - електростатично, координационно (включително поради водородни връзки), хидрофобно. По време на солватацията на йона зарядът се преразпределя с участието на заобикалящите го молекули на разтворителя. Като правилоразтварянето на йони в полярни разтворители е толкова по-силно, колкото по-полярен е разтворителят. Тъй като е изключително трудно да се вземе предвид целия набор от взаимодействия между йон и неговата среда, обикновено се използваемпиричното правило :(!) Колкото по-малък е размерът на йона и колкото повече зарядът е локализиран в него, толкова по-добре се солватира.
Труден за тълкуване е въпросът за връзката между киселинността на съединенията във водната среда и газовата фаза. Развитието на методите за йонен циклотронен резонанс и масспектрометрия с високо налягане предоставиха възможност за сравнително точни определяния на термодинамичните равновесия в газовата фаза. По този начин беше установено, че оцетната киселина и фенолът в газовата фаза са близки по киселинност, докато във водата pKa на тези съединения се различават с пет порядъка поради ефекта на хидратация на аниони. Смята се, че делокализацията на отрицателния заряд по бензеновия пръстен във фенолатния йон намалява способността му да образува водородни връзки с водата. Присъщата киселинност на алифатните алкохоли в газовата фаза се увеличава с дължината и разклонението на алкилния радикал:
Алкилните групи могат да участват в делокализацията на отрицателния заряд, тъй като кислородният атом, носещ отрицателния заряд, е донор на електрони по отношение на алкиловите групи. Във воден разтвор горният ред на нарастване на киселинните свойства на тези алкохоли е обърнат. Това обръщане на редица киселинни свойства във водата в сравнение с газовата фаза се обяснява с по-добра хидратация на малкия етоксиден йон и по-слаба хидратация на обемния терт-бутоксиден йон. В газовата фаза алкохолите са по-силни киселини от водата; във воден разтвор - по-слаби киселини от водата:
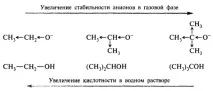
По този начин ефектът от солватацията може да бъде по-мощен от електронните ефекти на заместителите. При прогнозиране на преобладаващото влияние може да се ръководи главно от ограничаващи случаи:
• в молекули с рязко различниразмера на въглеводородните радикали, енергийният принос на солватацията е по-голям от този на електронните ефекти. В разтвор, в сравнение с газовата фаза, серията на киселинността е обърната;
• в молекули с близки по размер въглеводородни радикали (феноли, ароматни киселини и др.), енергийният принос на ефекта на солватация е по-малък от този на електронните ефекти. Редът на промяна на киселинността в газовата фаза и във водната среда е един и същ.