Втори закон на термодинамиката
План
2.1. Вторият закон на термодинамиката. Ентропия.
2.2. Свободна енергия на Гибс.
2.3. Биоенергия.
Вторият закон на термодинамиката. Ентропия
Химичните реакции и физико-химичните процеси могат да се разделят на две групи: спонтанни (спонтанни) и неспонтанни (неспонтанни).
Спонтанните процеси протичат без допълнителна енергия от околната среда да бъде предадена на системата. Спонтанни са процесите на разтваряне, дифузия, осмоза, разширяване на газа в празно пространство. Границата на спонтанните процеси е състоянието на термодинамично равновесие.
Термодинамично равновесие — е състояние на система, при което нейните термодинамични параметри (T, p, V и т.н.) не се променят във времето и имат една и съща стойност във всички точки от обема на системата. Система в равновесие не е в състояние да върши работа. Термодинамично равновесие се постига само в затворени и изолирани системи. Не е постижимо за отворени системи поради постоянно променящите се външни условия. За отворените системи аналог на равновесието естационарно състояние, което се дължи на баланса на енергията и потоците на материя в и от системата. Стационарното състояние се характеризира с дългосрочно постоянство на термодинамичните параметри на системата и едновременна способност за извършване на полезна работа.
За протичането на неспонтанни процеси е необходимо системата да се осигури допълнителна енергия. Например фотосинтезата, протичаща под въздействието на UV радиация.
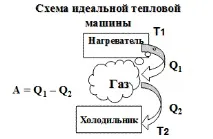
Фигура 1 — Схема на идеална топлинна машина
Голям принос в изучаването на теорията на топлинните двигатели направи френският инженер С. Карно.
Теорема на Карно:
1) Ефективността на топлинния двигател не зависи от вида на работния флуид, а зависи само от температурите на нагревателя и хладилника.
2) Ефективността на топлинния двигател винаги е по-малка от единица (уравнение на Карно):
Тъй като T2 ≠ 0 (абсолютната нула не е постижима), тогава ефективността -23 J/K,
W е термодинамичната вероятност на системата, т.е. броя на микросъстоянията, чрез които се реализира дадено макросъстояние.
Микросъстоянието е скоростта, енергията, импулсът на движение и други характеристики на всяка отделна структурна единица. Колкото по-малък е броят на микросъстоянията, толкова по-висока е подредеността на системата. Така че, ако всички структурни единици на системата имат еднакви енергийни характеристики, тогава термодинамичната вероятност на системата е 1, а ентропията е 0. Ако структурните единици на системата имат различни енергийни характеристики, тогава W>1 и S>0 (Фигура 2)
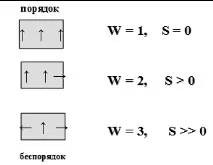
Фигура 2 — Връзка между термодинамичната вероятност на система и нейната ентропия
Ентропията е количествена мярка за безпорядъка в системата. Колкото по-голяма е ентропията на системата, толкова по-голям е безпорядъкът в нея.
Изчисляването на ентропията на химическа реакция (ΔrS) се основава на закона на Хес. За условен отговор:
ентропията може да се изчисли като:
ΔrS = c S (C) + d S (D) – a S (A) – b S (B),
където S е моларната ентропия на веществото, J/mol·K.
Ако ΔrS > 0 - реакцияпротича с нарастващо разстройство;
ако ΔrS 0); съответно ∆G 0. Така спонтанно протичат тези процеси, чието протичане е придружено от намаляване на свободната енергия на Гибс.
Природата на процеса понякога може да бъде променена чрез промяна на термодинамичните параметри на системата: температура, налягане или концентрация на реагентите (Таблица 2).
Таблица 2 - Влияние на температурата върху характера на процеса