Взаимодействие на червата с микрофлората и тяхното взаимно влияние
Има доказателства, чемикроорганизмитемогат да имат различен ефект върху функцията на червата. Вероятно синергизмът на многото микроорганизми, които изграждат чревната микробиота, е важен за нормалното й функциониране и подходящия контрол на патогенните микроорганизми.
Микрофлората зависи не само отмикроорганизмите, обитаващи червата, но и от собствените чревни защитни механизми на гостоприемника. Червата имат няколко физиологични бариери срещу бактериите: перисталтика, стомашен сок, протеолитични ензими, чревна слуз, повърхностни клетъчни гликоконюгати и плътно прилепване на чревните епителни клетки една към друга.
Всички тези бариери ограничават броя набактериитев чревната кухина и предотвратяват тяхното фиксиране и проникване през чревния епител. Червата също имат сложна имунна защитна система на гостоприемника. Освен това съществуват биохимични фактори, чиято роля е да ограничат растежа на микроорганизмите, проникнали през физиологичната бариера. Това саТ- и В-лимфоцити, секреторен имуноглобулин А, дефензини, секретирани от клетки на Панет, и трифолиатен фактор, секретиран директно от чревния епител.
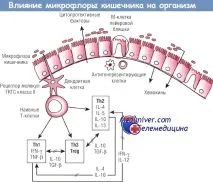
В червата имасистема за взаимодействие с микрофлората. Благодарение на тази система е възможно да се разпознаят коменсални бактерии, към които имунните фактори са толерантни, и патогенни микроорганизми, които предизвикват възпалителни и имунни реакции. Три вида клетки участват в разпознаването на микробната среда: М клетки, повърхностни ентероцити и дендритни клетки.
М-клеткитесе намират в целия храносмилателен тракт като част от специален епител в мукозните лимфоидни фоликули или пейеровите петна. М клеткимогат да транспортират антигени и бактерии през епитела до субепителни дендритни клетки чрез активен везикуларен транспорт, използвайки клатрин-зависима ендоцитоза, пиноцитоза или фагоцитоза.
Смята се, че този процесрегулира комменсалната микрофлораи осигурява реакция с участието на антитела от имуноглобулин (Ig) клас А. Този механизъм активира имунния отговор, но има възможност за проникване на патогенни микроорганизми през лигавицата.
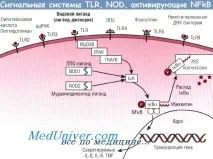
Повърхностните ентероцити разпознаватбактериис помощта на серия от рецептори, които разпознават молекулярните структури на микроорганизмите (свързани с патогени молекулярни модели). Тези рецептори се наричат Toll-подобни рецептори, всеки от които разпознава специфични бактериални структури.
Например,TLR2разпознава такива Грам-положителни структуримикроорганизми, като пептидогликан и липотейхоева киселина, TLR4 - липополизахариди на грам-отрицателни микроорганизми, TLR5 разпознава флагелин - провъзпалителен елемент от флагела (флагелума) на бактериите и TLR9 - неметилирана ДНК на бактерии. Свързването към някой от тези рецептори води до активиране на NFkB. В допълнение, вътреклетъчните NOD1 и NOD2 рецептори също разпознават бактериални фрагменти като LPS и активират NFkB.
NFkBе група от структурно свързани протеини, които активират транскрипцията на различни гени, участващи във възпалителни и имунни реакции. В неактивно състояние NFkB димерите са свързани в цитоплазмата с IkB (IkB протеини). Клетъчната стимулация може да задейства механизъм на сигнална трансдукция, водещ до активиране на IkK, който след това фосфорилира IkB, което води до разрушаване в протеазомата.
NFkB, освободен по този начин, се придвижва към ядрото, където активира генната транскрипция, повишавайки синтеза на цитокини (IL-6, TNF-a), хемокини (IL-8), адхезионни молекули и регулатори на апоптозата.
Дендритните клеткиса антиген-представящите клетки на червата. Те могат да бъдат разположени между повърхностни ентероцити, без да нарушават плътните връзки и да пренасят живи бактерии или техните антигени към мезентериалните лимфни възли за имунен отговор. Дендритните клетки, експресиращи клас II МНС молекули, са хранителни или бактериални антигени, които влизат в контакт с чревния епител и наивните Т-лимфоцити на Пейеровите петна.
Имунният отговор на черватакъм тези бактериални сигнали обикновено може да бъде представен от два класа CD4+ Т клетки, които се различават по спектъра на произведените цитокини. T хелпер (Th) тип 1 произвежда интерферон (IFN) y и TNF-b. Тези цитокининеобходими за развитието на клетъчния имунитет. Неадекватният отговор с доминиране на Th1 е свързан с появата на автоимунни заболявания. Th2 произвежда IL-4, IL-5, IL-10 и IL-13. Тези цитокини са свързани с развитието на IgE отговор.
Неадекватенотговор с доминиране на Th2води до алергия и атопия. Активирането и диференциацията на CD4+ Т-лимфоцитите зависи както от вида и количеството на антигена, така и от баланса на цитокините. Наличието на IL-12 води до активиране на Th1 отговора, докато наличието на IL-4 води до Th2 отговора.
При възрастенздрав човекима прецизна регулация на имунните реакции (възпалителни и алергични). При нормални условия чревната слуз е в постоянно "потиснато" състояние поради повишени нива на TGF-b и IL-10, произведени от регулаторните Т клетки и Th3.
Когатобактериите проникнат през мукозната бариера, започва процесът на иницииране на разпознаване на микробни структури от Toll-подобни рецептори и се задейства Th1 отговорът, докато Th2 отговорът се потиска, което води до активиране на съответната възпалителна реакция, която предотвратява бактериалната инвазия. Ако няма нужда от имунен отговор, Th2 клетките произвеждат IL-4 и IL-10, което води до потискане на Th1 клетките, които произвеждат IFN-y и IL-12, и балансът се връща в първоначалното си състояние. Нарушаването на регулацията може да доведе до развитие на неподходящ имунен отговор към бактерии (възпалително заболяване на червата) или към хранителни антигени (хранителна алергия или целиакия).