Взаимодействия между молекулите
Взаимодействия между молекулите - раздел Химия, Основи на неорганичната химия При приближаване на молекулите се появява привличане, което предизвиква възникването.
Когато молекулите се приближават една към друга, се появява привличане, което причинява появата на кондензирано състояние на материята. Основните типове молекулярни взаимодействия включват ван дер ваалсови сили, водородни връзки и донорно-акцепторно взаимодействие.
4.8.1. Сили на Ван дер Ваалс. През 1873 г. холандският учен И. ван дер Ваалс предполага, че има сили, които причиняват привличане между молекулите. Тези сили по-късно бяха наречени сили на Ван дер Ваалс. Те включват три компонента: дипол-диполни, индукционни и дисперсионни взаимодействия.
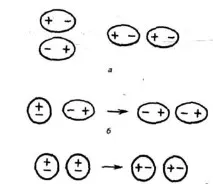
може да повлияе
превръщайки ги в индуцирани (индуцирани) диполи (фиг.21).Между постоянните и индуцираните диполи съществува привличане, чиято енергия е пропорционална на електричния момент на дипола на втора степен и обратно пропорционална на разстоянието между центровете на молекулите на шеста степен. Енергията на индуктивното взаимодействие се увеличава с увеличаване на поляризуемостта на молекулите, т.е. способността на молекулата да образува дипол под въздействието на електриченполета. Стойността на поляризуемостта се изразява в единици обем. Поляризираемостта в молекули от един и същи тип се увеличава с увеличаване на размера на молекулата (Таблица 14). Енергията на индуктивното взаимодействие е много по-малка от енергията на взаимодействието дипол-дипол (Таблица 14).
Тази тема принадлежи към раздела:
Основи на неорганичната химия
Основи.. неорганична химия..
Какво ще правим с получения материал:
Всички теми в този раздел:
Основни закони и понятия на химията Раздел от химията, който разглежда количествения състав на веществата и количествените съотношения (маса, обем) между реагиращите вещества, се нарича стехиометрия. Според това,
Химическа символика Съвременните символи на химичните елементи са въведени през 1813 г. от Берцелиус. Елементите се обозначават с началните букви на техните латински имена. Например кислородът (Oxygenium) се обозначава с буквата O, se
Латински корени на някои елементи Пореден номер в таблицата на периодичната система Символ Българско име Латински корен
Групови имена на елементи Име на група елементи Групови елементи Благородни газове He, Ne, Ar, Kr, Xe, Rn Халогени
Имена на най-често използваните киселини и киселинни остатъци Киселинни формули Име на киселината Формула на киселинния остатък Име на киселинния остатък Кислородни киселини
Получаване на киселини 1. Взаимодействие на киселинни оксиди (повечето) с вода: SO3 + H2O=H2SO4; N2O5 + H2
Номенклатура на неорганичните съединения (съгласно правилата на IUPAC) IUPAC е международен съюз по теоретична и приложна химия. Правилата на IUPAC от 1970 г. са международният модел, чрез който се създават номенклатурните правила за химически съединения на езика COO.
Първите модели на атома През 1897 г. Дж. Томсън (Англия) открива електрона, а през 1909г. R. Mulliken определи неговия заряд, който е 1,6 10-19 C. Масата на електрона е 9,11 10-28 g V
Атомни спектри При нагряване материята излъчва лъчи (радиация). Ако излъчването има една дължина на вълната, то се нарича монохроматично. В повечето случаи радиацията се характеризира с няколко
Квантите и моделът на Бор През 1900 г. М. Планк (Германия) предполага, че веществата абсорбират и излъчват енергия на отделни порции, които той нарича кванти. Квантовата енергия E е пропорционална на честотата на излъчване (co
Двойствената природа на електрона През 1905 г. Айнщайн прогнозира, че всяка радиация е поток от енергийни кванти, наречени фотони. От теорията на Айнщайн следва, че светлината има двойна (частица-вълна
Енергийни поднива Орбитално квантово число l Формата на електронния облак в поднивото Промяна в енергията на електроните в рамките на нивото
Стойности на квантовите числа и максимален брой електрони на квантови нива и поднива Квантово магнитно квантово число ml Брой квантови състояния (орбитали) Максимален брой електрони  
Водородни изотопи Изотоп Ядрен заряд (сериен номер) Брой електрони Атомна маса Брой неутрони N=A-Z Протий
Периодична система от елементи D.I. Менделеев и електронната структура на атомите Нека разгледаме връзката между позицията на елемент в периодичната система и електронната структура на неговите атоми. Всеки следващ елемент в периодичната система има един електрон повече от предишния.
Електронни конфигурации на елементите от първите два периода Атомен номер Елемент Електронни конфигурации Атомен номер Елемент Електроненконфигурация
Електронна конфигурация на елементи Елемент с пореден номер на период Електронна конфигурация Елемент с пореден номер на период
Периодични свойства на елементи Тъй като електронната структура на елементите се променя периодично, свойствата на елементите, определени от тяхната електронна структура, като йонизационна енергия,
Степени на окисление на арсен, селен, бром Елемент Степен на окисление Съединения най-висока най-ниска
Определение за химична връзка Свойствата на веществата зависят от техния състав, структура, от вида на химичната връзка между атомите в дадено вещество. Химическата връзка е електрическа по природа. Под химическа връзка се разбира
Йонна връзка Когато се образува някаква молекула, атомите на тази молекула се „свързват“ един към друг. Причината за образуването на молекули е, че между атомите в молекулата действат електростатични сили. Образова
Ковалентна връзка Химическа връзка, осъществявана от припокриващи се електронни облаци от взаимодействащи атоми, се нарича ковалентна връзка. 4.3.1. Неполярни подковачи
Методът на валентните връзки (MVS, VS) За задълбочено разбиране на същността на ковалентната връзка, естеството на разпределението на електронната плътност в молекулата, принципите на конструиране на молекули на прости и сложни вещества е необходим методът на валентните връзки
Метод на молекулярната орбита (MMO, MO) Хронологично методът MO се появява по-късно от метода BC, тъй като в теорията на ковалентните връзки имаше въпроси, които не могат да бъдат обяснени с метода BC. Нека посочим някои от тях. как
Основни разпоредби на IMO, MO 1. В една молекула всички електрони са споделени. Самата молекула е едно цяло, сбор от ядра и електрони. 2. В молекула за всекиелектронът съответства на молекулна орбитала, като
Хибридизация на орбитали и пространствена конфигурация на молекули Тип молекула Първоначални орбитали на атом A Тип хибридизация Брой хибридни орбитали на атом A Pr
Метална връзка Самото име казва, че ще говорим за вътрешната структура на металите. Атомите на повечето метали на външно енергийно ниво съдържат малък брой електрони. И така, по един електрон всеки
Водородна връзка Водородната връзка е вид химична връзка. Това се случва между молекули, които включват водород и силно електроотрицателен елемент. Тези елементи са флуор, кислород
Приносът на отделните компоненти към енергията на междумолекулното взаимодействие
Общи понятия Когато протичат химични реакции, енергийното състояние на системата, в която протича тази реакция, се променя. Състоянието на системата се характеризира с термодинамични параметри (p, T, s и др.)
Вътрешна енергия. Първият закон на термодинамиката При химичните реакции настъпват дълбоки качествени промени в системата, връзките в изходните вещества се разкъсват и в крайните продукти се появяват нови връзки. Тези промени са придружени от абсорбция
Енталпията на системата. Топлинни ефекти на химичните реакции Топлината Q и работата A не са функции на състоянието, защото те служат като форми на пренос на енергия и са свързани с процеса, а не със състоянието на системата. В химичните реакции А е работата срещу външното
Термохимични изчисления Термохимичните изчисления се основават на закона на Хес, който ви позволява да изчислите енталпията на химическа реакция: топлинният ефект на реакцията зависи само от природата иагрегатното състояние на изходните вещества
химически афинитет. Ентропия на химичните реакции. Енергия на Гибс Реакциите могат да възникнат спонтанно, придружени не само от освобождаване, но и от поглъщане на топлина. Реакция, която протича при дадена температура с отделяне на топлина, при различна температура
Вторият и третият закон на термодинамиката За системи, които не обменят нито енергия, нито материя с околната среда (изолирани системи), вторият закон на термодинамиката има следната формулировка: в изолирани системи само
Концепцията за скоростта на химичните реакции Скоростта на химичната реакция е броят на елементарните актове на реакция, протичащи за единица време в единица обем (в случай на хомогенни реакции) или на единица повърхност (в
Зависимостта на скоростта на реакцията от концентрацията на реагентите За да реагират атом и молекули, те трябва да се сблъскат един с друг, тъй като силите на химичното взаимодействие действат само на много малко разстояние. Колкото повече реа молекули
Ефектът на температурата върху скоростта на реакцията Зависимостта на скоростта на реакцията от температурата се определя от правилото на van't Hoff, според което с повишаване на температурата на всеки 10 градуса скоростта на повечето реакции се увеличава с 2-
Енергия на активиране Бързата промяна в скоростта на реакцията с температурата се обяснява с теорията за активиране. Защо нагряването причинява толкова значително ускоряване на химичните трансформации? За да отговорите на този въпрос, трябва
Понятие за катализа и катализатори Катализата е промяна в скоростта на химичните реакции в присъствието на вещества - катализатори. Катализаторите са вещества, които променят скоростта на реакцията чрез участие в междинен химикал
химическиравновесие. Принцип на Le Chatelier Реакциите, които протичат в една посока и отиват до края, се наричат необратими. Не са много от тях. Повечето реакции са обратими, т.е. те се движат в противоположни посоки
Колигативни свойства на разтворите Колигативните свойства са разтвори, които зависят от концентрацията и практически не зависят от природата на разтворените вещества. Те се наричат още общи (колективни). T
Електролитни разтвори Примери за електролитни разтвори са разтвори на основи, соли и неорганични киселини във вода, разтвори на редица соли и течен амоняк и някои органични разтворители, като ацетонит
В разтвори при 298 K Концентрация, mol/1000g Н2О Коефициент на активност за електролити NaCl KCl NaOH KOH
Хидролиза на соли Химично обменно взаимодействие на разтворени солни йони с вода, което води до образуването на слабо дисоцииращи се продукти (молекули на слаби киселини или основи, киселинни аниони или основни катиони
Константи на дисоциация и степени на някои слаби електролити Електролити Формула Числени стойности на константите на дисоциация Степен на дисоциация в 0,1 n. разтвор, % Азотисти киселини
Процеси Редокс реакциите са реакции, придружени от промяна в степента на окисление на атомите, които изграждат реагиращите вещества [2].
Валентности и степени на окисление на атомите в някои съединения Молекула Йонност на връзката,% Атом
Редокс реакции Нека разгледаме основните положения на теорията на редокс реакциите. 1. Окислението е процес на отдаване на електрони от атом, молекула или йон. Степента на окисление в този случай
Най-важните редуциращи агенти и окислители Редуциращи агенти Окислители Метали, водород, въглища Въглероден оксид (II) CO Сероводород H2S, натриев сулфид Na2S, ce оксид
Съставяне на уравнения на редокс реакции За съставяне на уравнения на редокс реакции и определяне на коефициентите се използват два метода: метод на електронен баланс и йонно-електронен метод (метод на полуреакция).
Определяне на комплексни съединения Съединения като оксиди, киселини, основи, соли се образуват от атоми в резултат на образуването на химична връзка между тях. Това са обикновени връзки или връзки от първа линия.
Лиганди Лигандите включват прости аниони като F-, CI-, Br-, I-, S2-, сложни аниони като CN–, NCS–, NO
Номенклатура на комплексни съединения Името на комплексния катион се изписва с една дума, като се започва с името на отрицателния лиганд и се добавя буквата "o", след това се дават неутралните молекули и централния атом, което показва
Дисоциация на комплексни съединения Комплексни съединения - неелектролити във водни разтвори не претърпяват дисоциация. При тях липсва външната сфера на комплекса, например: [Zn(NH3)2Cl2], [Co(NH
Константи на стабилност на комплекси За характеризиране на стабилността (силата) на комплексния йон се използва също реципрочната стойност на константата на нестабилност. Нарича се константа на стабилност (KUST)
Ролята на комплексните съединения Комплексните съединения са широко разпространени в природата. Много растения и живи организми съдържат съединения с макроциклични лиганди. В опростена форма тетрадентатният макроцикъл на порите