28. Топлинна мощност. Моларен и специфичен топлинен капацитет.връзка между тях. Формула на Майер.
Количеството топлина, което повишава температурата на тялото с един градус, се нарича топлинен капацитет. Според това определение
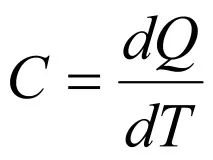
Топлинният капацитет на единица маса се наричаспецифичентоплинен капацитет. Топлинният капацитет на мол се наричамоларентоплинен капацитет.
И така, топлинният капацитет се определя чрез концепцията за количеството топлина. Но последното, подобно на работата, зависи от процеса. Това означава, че топлинният капацитет зависи от процеса. Възможно е да се придаде топлина - да се загрее тялото - при различни условия. Въпреки това, при различни условия, същото повишаване на телесната температура ще изисква различно количество топлина. Следователно, телата могат да се характеризират не с един топлинен капацитет, а с безброй множество (колкото можете да се сетите за всички видове процеси, при които се извършва пренос на топлина). На практика обаче обикновено се използва определението за два топлинни капацитета: топлинен капацитет при постоянен обем и топлинен капацитет при постоянно налягане.
Топлинният капацитет е различен в зависимост от условията, при които се нагрява тялото - при постоянен обем или при постоянно налягане.
Ако тялото се нагрява при постоянен обем, т.е.dV= 0, тогава работата е нула. В този случай топлината, предадена на тялото, отива само за промяна на вътрешната му енергия,dQ=dE, и в този случай топлинният капацитет е равен на промяната на вътрешната енергия при промяна на температурата с 1 K, т.е.
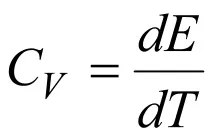
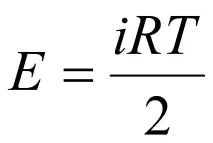
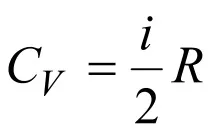
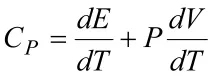
За идеален газPV=RTи следователноPdV=RdT.
Като вземем предвид това, намираме
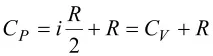
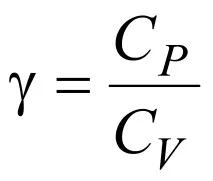
Формулите Ф
Връзка между моларен топлинен капацитет и специфичен топлинен капацитетC=M•c, където c еспецифичен топлинен капацитет, M емоларна маса.Формула на Майер.
За всеки идеален газ е валидна връзката на Майер:
, където R е универсалната газова константа, е моларният топлинен капацитет при постоянно налягане, е моларният топлинен капацитет при постоянен обем.