3. Повърхностни явления. Адсорбция
3.1. Движещи сили на адсорбцията
Досега разглеждахме междинните равновесия и разпределенията на компонентите между фазите. Какво се случва на интерфейсите?
Адсорбция– спонтанна концентрация на вещество на границата. Движещата сила на процеса на адсорбция е некомпенсирането на междумолекулните взаимодействия на фазовата граница в сравнение с тези вътре в по-голямата част от фазите. Ако химичните (ковалентни) връзки не се образуват на фазовата граница, тогава междумолекулните взаимодействия, отговорни за адсорбцията, могат да бъдат водородни връзки, йон-дипол, дипол-дипол, индукция, дисперсия (помнете общата химия и използвайте допълнителна литература [2, 3]).
В резултат на некомпенсирани междумолекулни взаимодействия задължително възниква излишна повърхностна енергия на Гибс:
където,е площта на фазовия интерфейс (m 2 ),е свръхспецифичната повърхностна енергия (J/m 2 ).
Спонтанно в многофазна система могат да протичат само процеси с намаляване на тази енергия (ΔGS2 =N/m).
Разгледайтезависимостите на разтвора от концентрацията на разтвореното вещество (с). С увеличаване на концентрацията на воден разтвор,може или да намалее (разтворените вещества в този случай се наричат повърхностно активни, повърхностноактивни вещества), или да се увеличи (такива вещества саповърхностно неактивни, PIAS).
Количествено и двете зависимости се описват с адсорбционната формула на Гибс:
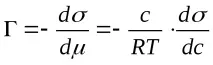
където Г е излишъкът от материя на границата, т.е. върху повърхността на течността (т.нар. адсорбция на Гибс, mol/m 2 ) спрямо обема на разтвора,с– концентрация на разтвореното вещество (mol/l), (dσ/dc) -повърхностдейност.