ЧАСТИЧНИ МОЛАРНИ СТОЙНОСТИ, Енциклопедия по химия
ЧАСТИЧНИ МОЛАРНИ СТОЙНОСТИ, термодинамични количества, които се използват за описване на концентрацията. зависимости св. в р-р. Нека M е някаква екстензивна функция на състоянието на система от h компоненти, т.е. свойство, което зависи от масата на системата (обем, вътрешна енергия, енталпия, ентропия, енергия на Гибс, енергия на Хелмхолц, топлинен капацитет и т.н.). За i-тия компонент частичната моларна стойност M i - се определя от отношението:
тези. е равно на производната на стойността М по отношение на броя молове m i на компонент i при постоянен t-re T, налягане p и броя молове на всички други компоненти. И така, частичен моларен обем
където G е енергията на Гибс на системата.
Частичната моларна стойност характеризира промяната в стойността на М, когато 1 мол от компонента i се добави към безкрайно голям брой p-ra при условия на постоянство на T, p и броя молове на всички останали компоненти. Ако моларната фракция x i на компонент е равна на единица, тогава частичната моларна стойност M i става моларната стойност M m за отделното вещество (напр. частичният моларен обем на компонента се преобразува в моларен обем). Стойността на M i се определя не само от естеството на i-тия компонент, но и от St. you на системата като цяло, тъй като молекулите на i-тия компонент на взаимодействието. с всички други молекули; имплицитно, тази стойност отчита всички промени в sv-в системата при създаване на i-тия компонент.
В реален разтвор, в общия случай, всички частични моларни количества зависят от състава, налягането и t-ry. Ако разтворът е идеален, тогава за дадени T и p, частичният моларен обем, ext. енергията, енталпията и топлинният капацитет са постоянни в целия концентрационен диапазон и съвпадат със съответните моларни стойности на чистите компоненти. Chem. потенциал m i id и частиченмоларната ентропия S i id са свързани със съответните моларни стойности на чиста in-va - енергия на Гибс и ентропия чрез съотношенията:
Зависимостта на частичните моларни количества от T и p се определя от същата термодинамика. отношения, като за съответните обширни св-в. И така, за хим. потенциал m i, се изпълняват отношения, подобни на тези, които са валидни за енергията на Гибс, а именно:
Функция M за системата като цяло е сумата от частичните моларни стойности на компонентите, умножени по съответния брой молове: M = M i m i . По-специално, енергията на Гибс на системата G = m i m i . Моларна (специфична) стойност M m =x i M i . Зависимости на моларната стойност на M m от T, p, x 1 , . , x n-1 се използват за намиране на частични моларни стойности:
За приблизително определение използвайте графика. метод (виж фигурата). В случай на двоична система
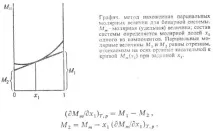
Промените в частичните моларни количества с промяна в състоянието на системата са свързани помежду си с уравнението на Гибс-Дюхем, което е написано в обобщена форма, както следва. начин:
При T, p = const (изотермично-изобарни условия)
Съгласно това уравнение, в двоична система, частичните моларни количества M 1 и M 2 се променят в противоположни посоки, когато съставът се промени. Екстремумите на кривите M 1 (x 1 ) и M 2 (x 1 ), ако има такива, се наблюдават за един и същи състав и са противоположни по вид. Например за хим. потенциали
При T, p = const
Това съотношение се използва за изчисляване на хим. потенциален компонент р-ра на база концентрация. химически зависимости. потенциали на останалите компоненти и също се използва за тестване на термодинам. последователност на експериментите. данни захимически зависимости. потенциали от състава, т-ри и др.
Концепцията за частични моларни количества се използва широко, когато се разглежда хим. и фазови равновесия.
Лит .: Карапетянц М. X., Химическа термодинамика, 3 изд., М., 1975 г.; Физикохимия, изд. Б. П. Николски, 2-ро изд., Л., 1987. Н. А. Смирнова.