Даниел-Якоби галваничен елемент
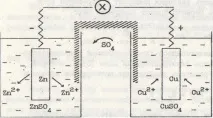
Помислете за принципа на работа и окислително-редукционните реакции, като използвате примера на медно-цинкова галванична клетка (Daniel-Jacobi) (фиг. 1).
Цинкът, който има отрицателен електроден потенциал, действа като анод и ще се окисли:
Zn o - 2e - → Zn 2+.
Медните йони ще бъдат редуцирани върху медния катод
Cu 2+ + 2e - → Cu o .
Общото уравнение на реакцията изглежда така:
Zn o + Cu 2+ → Zn 2+ + Cu o .
Диаграма на галванична клетка:
(-) Zn Zn SO4 Cu SO4 Cu (+). Благодарение на окислително-възстановителната реакция във външната верига протича електрически ток, който може да бъде открит от устройството, а SO4 2- йони се движат по вътрешната верига, като по този начин създават йонно равновесие в разтвора. Галваничният елемент работи, докато целият анод се разтвори или докато електродните потенциали на анода и катода приемат еднакви стойности.
Фиг. 1. Схема на медно-цинкова галванична клетка
Според стойностите на стандартните електродни потенциали или алгебричната сума на редокс потенциалите на конкретни реакции се определя ЕМП на елемента:
EMF \u003d 0,34 - (- 0,76) \u003d 1,1 V.
При промяна на стандартните условия изчислението се извършва с помощта на уравнението на Нернст.
Галваничен елемент, в който електродвижещата сила (ЕМС) възниква поради различни концентрации на електролитни разтвори, в които са потопени еднакви метални електроди, се наричаконцентрационен галваничен елемент.Електрод, потопен в солен разтвор с по-ниска концентрация, е анод, а с по-висока концентрация е катод.
Концентрационният галваничен елемент работи до изравняване на концентрациите на разтворите.
По време на работа на елемента, неговата ЕМП постепеннонамалява поради изместването на електродните потенциали от равновесното състояние. Това явление се нарича поляризация.
Лаборатория #3
ПРОИЗВОДСТВО НА ЕЛЕКТРИЧЕСКИ КЛЕТКИ
Опит 1. Изработване на медно-цинков елемент.
Напълнете едната епруветка догоре с 1 М разтвор на цинков сулфат, а другата с 1 М разтвор на меден сулфат. Свържете епруветките с електролитен мост, напълнен с наситен разтвор на калиев хлорид, смесен с агар-агар. Потопете цинкова плоча в разтвор на цинков сулфат ZnSO4 и медна плоча в разтвор на меден сулфат CuSO4 (предварително почистете плочите с шкурка). Свържете плочите с електрически проводник към галванометър. Наблюдавайте отклонението на стрелката на галванометъра, показващо възникването на електрически ток.
Направете схема на галваничен елемент. Напишете уравненията на химичните реакции, протичащи върху електродите на галванична клетка, и общото уравнение на химическата реакция, която води до електрически ток в тази клетка.
Използвайки числените стойности на стандартните електродни потенциали на цинк и мед, изчислете ЕМП на медно-цинковата галванична клетка.
В каква посока се движат електроните във външната верига? Кои йони се движат в разтвор и в каква посока?
Опит 2. Производство на концентрационен галваничен елемент.
Напълнете две епруветки с разтвори на меден сулфат с различни концентрации: първата с 2 М разтвор на CuSO4, втората с 0,02 М разтвор на CuSO4. Свържете тръбите с електролитен мост. Потопете медни пластини във всяка епруветка и ги свържете с жици към галванометър.
Направете схема на концентрационен галваничен елемент. Напишете уравненията на химичните процеси,тече върху електродите.
Използвайки стойността на стандартния потенциал на медния електрод и уравнението на Нернст, изчислете електродния потенциал на катода и анода, както и ЕМП на концентрационната галванична клетка.
Въпроси за самоконтрол
1. Какви устройства се наричат галванични?
2. Какво е двоен електрически слой?
3. Какъв е електродният потенциал? Изчислението му е според уравнението на Нернст.
4. Електрохимични серии от стандартни електродни потенциали. Неговата същност и практическо значение.
5. Какъв вид галванични клетки се наричат концентрационни клетки? Принцип на действие.
6. Изчислете потенциала на оловния електрод в наситен разтвор на оловен бромид, ако концентрацията на оловни йони е 10 -5 g-ion/L.
7. Колко ще се промени потенциалът на цинковия електрод, ако разтворът на цинковата сол, в който е потопен, се разреди 10 пъти?
8. Галваничният елемент реагира
Начертайте диаграма на елемента, покажете редокс процеса и изчислете EMF от стандартните стойности на катодния и анодния потенциал.
9. Какви процеси протичат върху електродите на галваничния елемент
Zn│Zn 2+ (C1) Zn 2+ (C2) │Zn (C1 2+ (0,1 M) Ag + (1 M) │Ag.
Cu │Cu 2+ (0,01 M) Ag + (2 M) │ Ag.
Cd │Cd 2+ (0,003 M) Cu 2+ (0,1 M) │Cu.
Тест за подготовка за изпит
1. Посочете вида енергия, която се генерира при работата на галванични клетки.
2. Електродвижещата сила на клетката се определя по формулата
3. Процесът, протичащ на анода в галванична клетка, -
3) окисление и редукция.
4. Процесът се изпълнявана катода в галванична клетка, -
3) окисление и редукция.
5. Посочете веригата на галваничния елемент, която е съставена правилно.
6. Стандартните електродни потенциали на мед и алуминий са съответно +0,34V; - 1,66 V. Какъв метал е анодът, ако веригата на галваничния елемент е изградена от медни и алуминиеви електроди?
7. Коя верига на галванична клетка е конфигурирана правилно?
8. Какъв тип енергия се преобразува в електрическа енергия в галванична клетка?
9. Стандартните електродни потенциали на мед и никел са съответно +0,34 V, -0,23 V. Кой метал е катодът, ако веригата на клетката е образувана от медни и никелови електроди?
3) никел и мед.
10. Стандартните електродни потенциали на мед, желязо и магнезий са съответно +0,34V; - 0,44 V; - 2.37 V. Кой метал е по-активен?
4) желязо и магнезий.
11. Какъв вид енергия преминава химическата енергия в галваничен елемент?
12. Коя верига на галванична клетка е конфигурирана правилно?
13. Стандартните електродни потенциали на олово и манган са съответно - 0,13 V; - 1,18 V. Какъв метал е анодът, ако веригата на галваничния елемент е съставена от манганови и оловни електроди?
14. Стандартните електродни потенциали на сребро и никел са съответно +0.80V; - 0,23 V. Какъв метал е катодът, ако веригата на галваничния елемент е съставена от сребърни и никелови електроди?
15. Стандартните електродни потенциали на никел и цинк са съответно - 0,23 V; - 0,76 V. Какъв метал е източникът на електрони, ако веригата на галваничния елемент се състои от два електрода:никел и цинк?
16. Стандартните електродни потенциали на желязото и алуминия са съответно - 0,44 V; - 1,66 V. Какъв процес протича върху алуминиев електрод, ако веригата на галваничния елемент се формира от два електрода: алуминий и желязо?
3) окисление и редукция.
17. Стандартните електродни потенциали на мед и цинк са съответно +0,34V; - 0,76 V. Галваничната верига се състои от два електрода: цинков и меден. Какъв процес протича върху меден електрод?
18. Каква реакция на генериране на ток протича в този галваничен елемент Zn ZnSO4 CuSO4 Cu?
1) Cu 0 + Cu +2 → Zn +2 + Zn 0;
2) Cu 0 + Zn +2 → Zn 0 + Cu +2;
3) Zn 0 + Cu +2 → Zn +2 + Cu 0;
4) Cu 0 + Zn 0 → Cu +2 + Zn +2.
19. Коя верига на галванична клетка е конфигурирана правилно?
20. Каква реакция на генериране на ток протича в този галваничен елемент Al Al2(SO4)3 FeSO4 Fe ?
1) 2Al 0 + 2Al +3 → 3Fe +2 + 3Fe 0;
2) 2Al 0 + Fe 0 → 2Al +3 + 3Fe +2;
3) 2Al 0 +3Fe +2 → 2Al +3 + 3Fe 0 .
21. Електродните потенциали на алуминий, цинк и злато са равни съответно - 1,70 V; - 0,76 V; + 1,50 V. Кой метал е по-активен?
22. Електродните потенциали на магнезий, цинк и мед са равни съответно - 2,37 V; - 0,76 V; + 0,34 V. Какви метали могат да бъдат аноди в галванични клетки?
23. Схема на галваничния елемент
Mg MgSO4 ZnSO4 Zn. Какъв процес протича на анода?
1) Zn 0 - 2e - ® Zn +2;
2) Mg 0 - 2e -® Mg +2;
3) Mg +2 +2e -® Mg 0;
4) Zn +2 +2e - ® Zn 0 .
24. Каква реакция на генериране на ток протича в този галваничен елемент ZnZnSO4 CuSO4 Cu ?
25. Какъв процес протича на катода в този Ni NiSO4 CuSO4 Cu галваничен елемент?
1) Cu 0 - 2e - ® Cu +2;
2) Cu +2 + 2e - ® Cu 0 ;
3) Ni 0 - 2e -® Ni +2;
4) Ni +2 + 2e -® Ni 0 .
| Номер на въпроса |
| Възможен отговор |
| Номер на въпроса |
| Възможен отговор |
| Номер на въпроса |
| Възможен отговор |
ЕЛЕКТРОЛИЗА
Електролизатасе нарича редокс реакции, протичащи върху електродите, когато постоянен електрически ток преминава през електролитен разтвор или през неговата стопилка.
Електродът, свързан към отрицателния полюс на източника на ток, се наричакатодВърху катода протича процес на възстановяване.
Електродът, свързан към положителния полюс на източника на ток, се наричаанод. Процесът на окисляване протича на анода.
Така в процесите на електролиза електрическата енергия се превръща в химическа. Естеството и протичането на електродните процеси по време на електролиза се влияят значително от: състава на електролита, разтворителя, материала на електродите, режима на електролиза (напрежение, плътност на тока, температура и др.).
Електролизата може да се осъществи не при каквато и да е потенциална разлика (напрежение), а при съвсем определен такъв, наречен потенциал на разлаганеEdec. Потенциалът на разлагане е най-ниското напрежение, при което започва електролизата на дадено съединение. Необходимо е да се прави разлика между електролизата на разтопени електролити и техните разтвори (с участието на вода).

Папиларните шарки на пръстите са маркер за атлетични способности: дерматоглифните знаци се образуват на 3-5 месеца от бременността, не се променятпрез целия живот.
Механично задържане на земни маси: Механичното задържане на земни маси на откос се осъществява чрез различни по изпълнение контрафорсни конструкции.
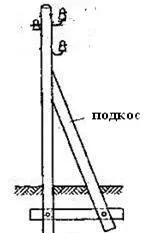
Дървена опора с една колона и начини за укрепване на ъглови опори: VL опорите са конструкции, предназначени да поддържат проводници на необходимата височина над земята, водата.