Диагностика и лечение на ототоксични кохлеовестибуларни нарушения, Павлюшина Е
*Импакт фактор за 2017 г. според RSCI
Списанието е включено в Списъка на рецензираните научни издания на ВАК.
Прочетете в новия брой
Увреждането на вътрешното ухо, придружено от загуба на слуха, шум в ушите и вестибуларни нарушения, може да бъде резултат от употребата, включително нерационална, на лекарства с известни ототоксични странични ефекти. Преди употребата на антибиотици арсенът, хининът, хлорохинът, салицилатите се смятаха за най-ототоксичните лекарства. По-късно тази група лекарства беше попълнена с аминогликозидни антибиотици (неомицин, канамицин, дихидрострептомицин, стрептомицин, тобрамицин, сизоцимин, амикацин, нетилмицин, рибостамицин, амикацин, метилмицин, тобрамицин, гентамицин, ципрофлоксацин, еритромицин), бримкови диуретици (ацетазоламид, етакринова киселина), нестероидни противовъзпалителни средства (НСПВС) (ацетилсалицилова киселина, натриев салицилат, диклофенак, ибупрофен, индометацин), противоракови лекарства - производни на платината (цисплатин, карбоплатин). Ятрогенни ефекти могат да се наблюдават и при приемане на инхибитори на ангиотензин-конвертиращия ензим (еналаприл, фозиноприл), анестетици (лидокаин), антидепресанти (амитриптилин, нортриптилин), антималарийни лекарства (хлорохин), блокери на калциевите канали (нифедипин, никардипин) и др. Трябва да се отбележи, че повече от 500 лекарства могат да причинят замайване.
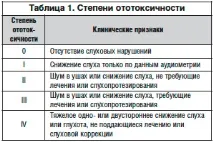
Няколко международни класификации са формулирали критерии за тежестта на ототоксичността. Според версията, разработена през 1988-1999 г. CTC-NCI (версия 2.0), ототоксичността се счита за независим вид токсичност, засягаща външни, вторични и/иливътрешно ухо. Различават се 4 степени на токсично увреждане на вътрешното ухо (Таблица 1).
В практическата медицина е важно да се оцени както тежестта на клиничните прояви на ототоксичност, така и качеството на живот на пациента. За тази цел е полезно да се използва фрагмент от Международната класификация на телесните функции, активност и участие (ICF), разработена от СЗО (2001).
Критерии (скали) за оценка на функционалните нарушения при ототоксично увреждане на вътрешното ухо (въз основа на ICF):
1. Звънене или шум в ушите.
3. Усещане за падане.
4. Гадене, свързано със световъртеж.
6. Да бъдеш в легнало положение.
7. Използване на прецизни движения с четка.
8. Движение в дома.
9. Ходене на къси разстояния.
10. Ходене на дълги разстояния.
11. Ползване на пътнически транспорт.
Оценяването се извършва по 5-бална скала (5 - абсолютни нарушения, 4 - тежки нарушения, 3 - умерени нарушения, 2 - леки нарушения, 1 - незначителни или липсващи нарушения).
Съвременната медицина разполага с цял арсенал от методи за инструментално изследване на пациенти с ототоксични кохлеовестибуларни нарушения, а именно:
От практическа гледна точка е важно да се разработи оптимална схема за изследване, включваща необходимия и достатъчен списък от изследвания.
Характеристика на хода на кохлеовестибуларните нарушения е автономният дисбаланс, който корелира с резултатите от оценката на състоянието на вегетативната нервна система чрез метода на вариационна тахипулсометрия. Проучванията потвърждават наличието на вегетативен дисбаланс при по-голямата част от пациентите с периферни кохлеовестибуларни нарушения, което налага провеждането на това изследване при всички пациенти сятрогенна ототоксичност.
Водещо място сред ототоксичните лекарства заемат антибиотиците от серията аминогликозиди [5, 8]. Освен това информация за ототоксичния ефект на аминогликозидните антибиотици, по-специално стрептомицин, се появи веднага след откриването и употребата му за лечение на пациенти с туберкулозен менингит. Антибиотиците от тази серия, открити по-късно: гентамицин, неомицин, канамицин, дихидрострептомицин, тобрамицин, сизоцимин, амикацин, нетилмицин, рибостамицин също имат ототоксичен ефект, чиято честота при терапевтични концентрации на лекарството в серума достига 15-40% от случаите и зависи от възрастта на пациента, дозата на лекарството, честотата на приложение и продължителността на лечението.
Всички аминогликозиди имат отрицателен ефект върху вътрешното ухо, като някои от тях увреждат предимно спиралния орган, което клинично се проявява чрез сензоневрална загуба на слуха с различна тежест до глухота и шум в ушите, докато други увреждат вестибуларните структури на лабиринта, което води до тежко системно замаяност, атаксия и инхибиране на вестибуларната функция на лабиринтите. Така стрептомицинът и тобрамицинът са вестибулотоксични, особено при пациенти с бъбречна недостатъчност, а гентамицинът (който е повече от 2 пъти по-токсичен от стрептомицин) засяга главно кохлеята. Най-ранното увреждане на слуха настъпва при честоти 12-16 kHz и се установява чрез аудиологично изследване на слуха в разширен честотен диапазон. Последиците от токсичното излагане продължават 2-3 седмици, но при липса на адекватно лечение могат да станат необратими. Характерно е, че дори след спиране на лекарството прогресията на загубата на слуха при пациента не спира. Децата в ранна детска възраст са силно чувствителни към токсичния ефект на аминогликозидите.възраст. Най-тежкото и необратимо токсично увреждане на вътрешното ухо се развива при новородени, чиито майки са получавали лечение с аминогликозиди по време на бременност, което се обяснява със способността на тези антибиотици да проникнат през плацентарната бариера.
Натрупването на токсично лекарство в течностите на вътрешното ухо и увреждането на космения апарат на кохлеята се свързват със способността на аминогликозидите да възпрепятстват венозния отток от кохлеята и да причинят смущения в спиралния лигамент и съдовите ивици. Увреждането на слуха се определя и от продължаващия токсичен ефект на антибиотика, който е проникнал в перилимфното пространство [5, 8]. Аминогликозидите причиняват дегенеративни промени в ампулите на полукръговите канали и торбичките на вестибюла. Статокинетичната мембрана, клетките на ампулния гребен и елипсовидната торбичка са чувствителни към стрептомицин, а спиралният орган е чувствителен към канамицин.
При многократно инжектиране на антибиотика той се натрупва във външните космени клетки, съдовите ивици, спиралния лигамент и невроепителните елементи на вестибюла, което води до смъртта на тези структури. На първо място, смущения възникват в първия ред външни космени клетки на главната витка на кохлеята, които участват във възприемането на високочестотни звуци. Увеличаването на ототоксичния ефект е придружено от увреждане на втория и третия ред космени клетки, разпространение в други спирали на кохлеята, които реагират на нискочестотна звукова стимулация, а по-късно настъпват промени в нервните влакна и спиралния ганглий. По-рядко вътрешните космени клетки са включени в патологичния процес.
Платиновите препарати (цисплатин, карбоплатин) се използват широко в онкологичната практика. Въпреки това, наред с високата цитостатична активност, те имат редица странични ефекти.ефекти, включително нефро-, невро- и ототоксичност [1, 6, 7]. Експериментални радиоизотопни изследвания показват, че натрупването на цисплатин се извършва в различни структури на кохлеята, най-вече в съдовите ивици. На фона на химиотерапията с цисплатин, в случай на образуване на ототоксичен ефект, първите се увреждат поддържащите клетки на Deiters. С увеличаване на дозата и продължителността на действие на цисплатин, процесът на дегенерация се разпространява от базалната към апикалната намотка на кохлеята, включвайки външните и след това вътрешните космени клетки. По-високите дози причиняват дегенерация на съдовата ивица. Доказано е, че ототоксичността на цисплатин рязко се увеличава при нарушаване на отделителната функция на бъбреците и нарушено кръвоснабдяване на вътрешното ухо, индивидуалната и генетична предразположеност играе определена роля [1, 9, 11].
От НСПВС най-токсични за органа на слуха са салицилатите - ацетилсалицилова киселина и натриев салицилат поради ефекта им върху биоелектричните процеси в кохлеята поради нарушаване на проводимостта на мембраните на космените клетки. При продължителна употреба на значителни дози салицилати може да се развие сензоневрална загуба на слуха със загуба на слуха в диапазона 20-40 dB. По правило загубата на слуха и шумът в ушите са обратими и изчезват в рамките на 24-72 часа след спиране на ототоксичното лекарство.
Въпреки очевидния ототоксичен ефект, производните на платината (цисплатин и карбаплатин) днес са сред основните при лечението на редица солидни дисеминирани тумори с различна локализация, а аминогликозидите остават лекарства на избор при заболявания като туберкулоза, бруцелоза, туларемия, в комбинация с β-лактами и гликопептиди - при инфекциозен ендокардит, посттравматичен менингит, интраабдоминална инфекция, инфекция на органималък таз, остеомиелит, септичен артрит. Поради това е важна възможността за използване на лекарства и методи за избягване или намаляване на риска от развитие на странични ефекти на аминогликозидите, без да се отменят последните.
Важността на този проблем се доказва от многобройните предложени методи и методи за лекарствена и нелекарствена корекция на ототоксични кохлеовестибуларни нарушения.
Медикаментозното лечение и профилактика на ятрогенна ототоксичност включва използването на бетахистин дихидрохлорид, винпоцетин, антихипоксанти, никотинамид, цитохром С, диоксометилтетрахидропиримидин като защитни средства за сензорни нарушения, комбинирани препарати от витамини от група В.
Нелекарствените лечения за ятрогенна ототоксичност включват използването на рефлексология, хирудотерапия и хипербарна кислородна терапия.
В случай на ототоксични лезии на вестибуларната част на вътрешното ухо, повишаването на статокинетичната стабилност се улеснява от вестибуларното обучение [4]:
- активно обучение чрез гимнастически упражнения;
- пасивно обучение с помощта на различни въртящи се и люлеещи се инсталации (столът на Барани, инсталациите на Хилов, Маркарян, Стрелцов, Разсолов);
- смесена форма на вестибуларно обучение, което включва гимнастически упражнения и пасивни техники за повишаване на неспецифичната статокинетична стабилност.
Основният механизъм на антитуморния ефект на цисплатина се дължи на дестабилизирането на ДНК молекулата, образуването на адукти на цисплатина с ДНК, последваща фрагментация на ДНК и апоптоза на туморни клетки. Механизмът на развитие на ототоксичността на цисплатин е подобен на ефекта, който се получава върху вътрешното ухоаминогликозидни антибиотици. Разликата се състои в това, че аминогликозидите, за разлика от цисплатина, също увреждат вестибуларния лабиринт. Натрупването на цисплатин става в различни структури на кохлеята, най-вече в базиларната мембрана, вестибуларната скала, но три пъти повече в съдовата ивица. Поддържащите клетки на Deiters са първите, които се увреждат [10, 12]. С увеличаване на дозата и продължителността на действие на цисплатина, процесът на дегенерация се разпространява от базалната към апикалната намотка на кохлеята, включвайки външните и вътрешните космени клетки. Намален ендокохлеарен потенциал. Настъпват характерни промени: апоптоза, пикноза и индурация на ядрата, фрагментация на ДНК в кортиевия орган, спираловиден ганглий и съдова ивица [10, 13].
От 1995 г. арсеналът от химиотерапевтични средства е попълнен с нови лекарства с изразена антитуморна активност. Едно от тези лекарства, карбоплатин, има противотуморен механизъм, подобен на цисплатина, има приблизително същата клинична ефикасност като цисплатина срещу широк спектър от тумори, но е по-малко токсичен.
По този начин проблемът с индуцираната от лекарства ототоксичност все още остава актуален, изисквайки допълнителни научни и клинични изследвания.
- Бойцова Л.В. Промени в антиоксидантната система на глутатиона като индикатор за цитостатичния ефект на платидиам // Съвременни проблеми на токсикологията. 1998. № 3. С. 28–32.
- Кадимова M.I., Полякова T.S., Владимирова T.V. Приложението на Бетасерк при пациенти с кохлеовестибуларни нарушения // Бюлетин по оториноларингология. 1998. № 5. С. 49–50.
- Лебедева Л.И. Оценка на ототоксичността на химиотерапията при пациенти с дисеминирани злокачествени неоплазми: Дис. … канд. пчелен мед. науки. М.,2002 г.
- Морозова С.В., Войнаревич А.О., Лебедева Л.И., Павлюшина Е.М. Възможности за медикаментозна корекция на ототоксичността на цисплатина при химиотерапия на злокачествени тумори: Доклади от XII конгрес на оториноларинголозите в България. Нижни Новгород, 2006, стр. 390.
- Сагалович BM, Някои въпроси на физиологията и патофизиологията на вътрешното ухо: резюмета на доклади на VIII конгрес на оториноларинголозите на СССР. Суздал, 1982, с. 111–115.
- Топчиева С.В. Второ поколение платинови производни при химиотерапия на рак на яйчниците: Dis. … канд. пчелен мед. науки. М., 1999. 230 с.
- Тюляндин С.А. Рак на яйчниците. АСКО-2000. стр. 256–260.
- Хечинашвили С.Н. Физиология и патология на органа на слуха: резюмета на доклади на VIII конгрес на оториноларинголозите на СССР. Суздал, 1982, с. 107–110.
- Alam S.A., Ikeda K., Oshima T. et al. Индуцирана от цисплатин апоптотична клетъчна смърт в кохлеята на монголски гербил // Hear Res. 2000 том. 141. No 1-2. С. 28–38.
- Ford M.S., Nie Z., Whitworth C., Rybak L.P. и др. Повишаване на аденозина на рецепторите в кохлеята от цисплатин // Hear Res. 1997 том. 111. No 1-2. С. 143–152.
- Lautermann J., Song B. Диетата е рисков фактор при ототоксичността на цисплатин // Рак. 1995 том. 88. No 1-2. С. 47–53.
- Peters U., Preisler-Adams S., Hebeisen A. et al. Генетични полиморфизми на глутатион S-трансфераза и индивидуална чувствителност към ототоксичния ефект на цисплатин // Противоракови лекарства. 2000 том. 11. № 8. С. 639–643.
- Rosencweig M., Beltangadi M. Рандомизирани проучвания на карбоплатин цисплатин при напреднал рак на яйчниците. Настоящи перспективи и бъдещи насоки. 1990. С. 175–186.
Само за регистрирани потребители