Експериментално изследване на антивирусната активност на Ingavirin срещу човешки аденовирус
В. В. Зарубаев 1 , А. В. Слита 1 , А. К. Сироткин 1 , В. Е. Неболсин 2 и О. И. Киселев 1
Антивирусните свойства на Ingavirin ® срещу човешкия респираторен вирус, аденовирус тип 5, са изследвани с помощта на клетъчна култура HEp-2. При концентрации на Ingavirin® 1000, 100 и 10 µg/ml се образува вирусно потомство с намалена инфекциозност (съответно 250, 100 и 10 пъти). Електронномикроскопският анализ на инфектирани клетки потвърждава способността на Ingavirin ® да нарушава нормалната морфогенеза на аденовируса.Ключови думи: Ингавирин, човешки аденовирус тип 5, антивирусна активност, електронномикроскопски анализ, Hep-2 клетъчна култура.
Експериментално изследване на антивирусната активност на Ingavirin ® срещу човешки аденовирус
В. В. Зарубаев, А. В. Слита, А. К. Сироткин, В. Е. Неболсин, О. И. Киселев Научноизследователски институт по грип, Северозападен клон на Руската академия на медицинските науки, Санкт Петербург Valenta Farm, Москва
Въведение Въпреки напредъка в областта на ваксинацията, химиопрофилактиката и химиотерапията на човешките респираторни вирусни инфекции, тези заболявания все още заемат водещо място в структурата на човешката инфекциозна патология. В допълнение към грипа, значителна част от респираторните инфекции са заболявания, причинени от вируси от други семейства: корона, адено и парамиксовируси (респираторен синцитиален вирус и параинфлуенца вирус). В етиологичната структура на острите респираторни вирусни заболявания (ARVI) човешките аденовируси заемат значително място. Аденовирусните заболявания (AVD) са повсеместни и се регистрират през цялата година с увеличаване през зимно-пролетния период, причинявайки фарингит, рино-фаринготонзилит, фарингоконюнктивална треска,епидемичен кератоконюнктивит, бронхит и пневмония. Често се наблюдават отделни случаи, нозокомиални и локални огнища на заболяването в затворени групи от деца и възрастни. СПИН се причиняват от голяма група аденовируси, от които най-голямо значение за човешката патология имат типове 3, 4, 5, 7, 8, 14, 21. Аденовирус тип 5 се отнася до латентни вируси, които продължават да съществуват в лимфоидната тъкан на сливиците и аденоидите за дълго време, причинявайки остри респираторни инфекции при възрастни.
Активност срещу аденовирус е показана in vitro за нуклеотидни аналози [1, 2]. Рибавирин, използван за лечение на MS вирусна инфекция, е ефективен [3, 4], частично ефективен [5] или няма ефект [6, 7] срещу аденовирусна инфекция. Ганцикловир, който е ефективен срещу цитомегаловирусна инфекция, е ефективен срещу аденовирус както in vitro, така и in vivo [8, 9]. Въз основа на (S)-1-(3-хидрокси-2-фосфонилметоксипропил)цитозин, Gilead Sciences разработи Cidofovir с широк спектър на антивирусна активност [10–15]. Рибавирин, ганцикловир и цидофовир се използват с по-голям или по-малък успех за лечение на човешки аденовирусни патологии, включително хепатит, цистит и пневмония при имунокомпрометирани състояния при реципиенти на органи [3, 4, 6, 9]. В същото време изразените странични ефекти и способността на аденовируса да образува резистентни щамове ограничават употребата на тези лекарства [13, 16, 17].
Редица съединения от други класове, като липиди [18], акридони [19], имидазохинолини [20], както и други нуклеозидни аналози [1, 2, 21–24], също проявяват антиаденовирусна активност. Растежът на вируса в клетъчната култура може да бъде инхибиран от катехините на зеления чай, макар и във високи концентрации [25].
Интерфероновите препарати, използвани за лечение на респираторни инфекции, са ефективни главно когато се използват профилактично и не могат да се считат за основно лечение при тежки случаи на инфекция. Аденовирусите имат ефективни механизми за потискане на индуцираната от интерферон антивирусна каскада от реакции, в резултат на което са резистентни към действието на интерферона и неговите индуктори [26].
По този начин проблемът с намирането и разработването на нови антивирусни лекарства, които нямат странични ефекти и евентуално с по-широк спектър на действие, включително ефективност срещу аденовирус, е много актуален. По-рано беше показана активността на лекарството Ingavirin ® (2-(имидазол-4-ил) етанамид на пентандиова киселина-1,5) срещу грипния вирус. Ingavirin ® е нискомолекулен аналог на ендогенен пептидоамин, изолиран от морския мекотел Aplysia californica. Както in vitro експерименти [27], така и in vivo експерименти върху модела на грипна инфекция [28], беше показано, че лекарството е в състояние да ограничи репликацията на вируса в клетъчната култура и също така има висока защитна активност при експериментален грип при мишки.
Целта на това проучване е да се оценят антивирусните свойства на Ingavirin ® срещу друг човешки респираторен вирус, аденовирус тип 5.
Материал и методи Препарати. Веществото на препарата Ingavirin ® е използвано в работата под формата на бял кристален прах. Аликвотни части от лекарството се разреждат в средата за клетъчна култура Needle MEM (BioloT, Санкт Петербург, кат. # 1.3.3).
Вируси и клетки. В работата е използван човешки аденовирус тип 5 от колекцията от вирусни щамове на Изследователския институт по грип. Вирусът се култивира в HEp-2 клетки.
Изследване на антивирусната активност на лекарствата. За изследване на инфекциозносттаВирусното потомство на клетките се инкубира с тестваното лекарство в продължение на 1 час, след което вирусът (1000 CTD50 на клетка) се добавя към културалната течност и се инкубира в продължение на 1 час. Вирусът се култивира в продължение на 24 часа, клетките се изстъргват от ямките и инфекциозността на вирусното потомство се титрува. За да се направи това, серия от десетократни разреждания от 10 -1 до 10 -6 беше приготвена от материал, съдържащ виболгар в среда MEM. Заразените клетки се култивират при 37°C в 5% CO2 атмосфера в инкубатор Sanyo-175 с газов поток. Периодът на култивиране е 72 часа, след което клетките се използват за микротетразолиев тест (вижте по-долу).
Броят на жизнеспособните клетки се оценява с помощта на микротетразолиев тест. За да се направи това, клетките се промиват 2 пъти в продължение на 5 минути с фосфатно буфериран физиологичен разтвор и 100 μl от разтвор (0, 5 mg / ml) на 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолиев бромид (ICN Biochemicals Inc., Aurora, Ohio) във физиологичен разтвор се добавя към ямките на плаките. Клетките се инкубират при 37°С в атмосфера от 5% СО2 за 2 часа и се промиват за 5 минути с фосфатно буфериран физиологичен разтвор. Утайката се разтваря в 100 μl на ямка от DMSO, след което оптичната плътност в ямките на плаките се измерва на мултифункционален четец Victor 1420 (Perkin Elmer, Финландия) при дължина на вълната 535 nm. Резултатите от теста бяха използвани за оценка на дела на мъртвите клетки в контролните ямки и ямките с препарати.
Електронномикроскопски изследвания. Експерименталните култури бяха третирани с Ingavirin ® в концентрация от 1000 μg/ml 1 час преди заразяване с вируса (1000 CTD50 на клетка). 18 и 36 часа след заразяването, контролните и експерименталните клетъчни култури се фиксират с 1,5% разтвор на глутаралдехид върху средата.DMEM (pH 7.2), центрофугиран за 20 минути при 2000 rpm и фиксиран с 2.5% разтвор на OSO4. Клетките се дехидратират с нарастващи концентрации на ацетон и се вграждат в смес от епон/аралдит. Ултратънките срезове, получени на ултрамикротом Ultracut (Reichert, Австрия), бяха насрещно оцветени с уранил ацетат и оловен цитрат и прегледани на електронен микроскоп JEM-100S (JEOL, Япония) при инструментално увеличение от 5000–50000. Снимките са направени с филм FT-4SHD.
Статистическа обработка на данни. Статистическата обработка на резултатите (изчисляване на средни стойности и стандартни отклонения, както и изчисляване на 50% ефективни дози с помощта на линейна регресия) беше извършена с помощта на Microsoft Excel. Значимостта на разликите беше оценена чрез t-теста на Student. Разликите между групите се считат за значими, ако параметърът p не надвишава 0,05.
Резултати и дискусия Ефект на Ingavirin ® върху репликацията на аденовирус в клетъчна култура. В проведените експерименти е оценено влиянието на Ingavirin ® върху инфекциозността на образуваната в клетките вирусна популация. За тази цел вирусът се култивира в продължение на 24 часа в присъствието на Ingavirin® при различни концентрации, след което инфекциозността на вирусното потомство се титрира при втория пасаж. Данните за ефекта на Ingavirin ® върху инфекциозността на аденовируса са дадени в таблица. 1.
Таблица 1.
Аденовирусна репликация в HEp-2 клетки в присъствието на Ingavirin®
Както следва от представените данни, култивирането на аденовирус в присъствието на Ingavirin ® води до образуването на вирусно потомство с намалена инфекциозна активност. Степента на потискане на тази активност пряко зависи от концентрацията на използваното лекарство и при концентрация на Ingavirin® 1000, 100 и 10 μg / ml е2.4; 2.0 и 1.0 поръчки (250, 100 и 10 пъти), съответно.
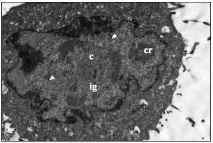
Ултраструктурни изследвания. Както е показано от ултраструктурни изследвания, заразените с Ad5 HEp-2 клетки са увеличени 18 часа след инфекцията. Клетъчните органели в цитоплазмата изглеждаха непокътнати. В самата цитоплазма започват процеси на вакуолизация, характерни за цитодеструктивното действие на аденовируса. Ядреният хроматин е разположен по протежение на вътрешния слой на ядрената мембрана; в кариоплазмата се наблюдава образуването на специфични аденовирусни включвания в ранните етапи на развитие. В състава на включванията ясно се разграничават централни зони с умерена електронна плътност, зони от интерхроматинови гранули с дребно-бучкаста гранулирана структура и електронно-плътни компактни пръстени по периферията на включванията (фиг. 1). Вириони с характерна икосаедрична форма са отбелязани в клетъчните ядра.
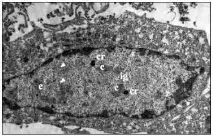
В клетките, заразени с аденовирус в присъствието на Ingavirin ®, признаците на ранните етапи на вирусна репликация са подобни на тези в клетките на контролната култура, без да се различават от тях нито качествено, нито количествено. Както и в контролните клетки, в кариоплазмата се наблюдава образуване на специфични аденовирусни включвания, в които ясно се разграничават централни зони с умерена електронна плътност, зони на интерхроматинови гранули и електронно-плътни компактни пръстени по периферията на включванията (фиг. 2). Няколко аденовирусни вириони бяха отбелязани в клетъчните ядра.
По този начин морфогенезата на самата аденовирусна инфекция в присъствието на Ingavirin ® не се различава фундаментално от контролните параметри. За по-пълно характеризиране на репродукцията на вируса се преброява броят на вирионите на клетка и се изчислява делът на морфологично дефектните вирусни частици (Таблица 2).
Таблица 2.
Морфологичен състав на популацията на човешки аденовирус тип 5, образуван при условията на употреба на Ingavirin ®
Същите тенденции се запазват и в по-късен период след заразяването (36 часа). Броят на вирусните частици в клетъчните ядра се увеличава многократно и изчислението му, като се вземе предвид изразеният цитодеструктивен ефект на вируса на този етап, не отразява адекватно динамиката на вирусната репродукция. Качествено, съставът на вирусната популация на този етап е показан на фиг. 3. Фигурата показва, че употребата на Ingavirin ® значително увеличава дела на незрелите вириони, които не съдържат сърцевината (фиг. 3).
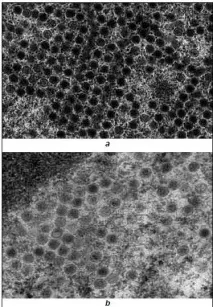
Получените резултати могат да се тълкуват като способността на Ingavirin ® да влияе пряко или косвено върху процесите на опаковане на вирусния геном в капсиди [29–31].
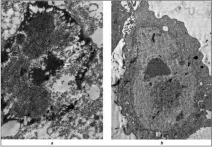
Като цяло получените данни ни позволяват да говорим за наличието на Ingavirin ® като ефективен механизъм за защита на клетките от аденовирусна инфекция, който се състои в способността да се наруши нормалната морфогенеза на аденовируса, като по този начин се намали инфекциозността на вирусното потомство.