Експериментът на Ръдърфорд върху разсейването на алфа частици (накратко)
Ърнест Ръдърфорд е един от основателите на фундаменталната теория за вътрешната структура на атома. Ученият е роден в Англия, в семейство на емигранти от Шотландия. Ръдърфорд беше четвъртото дете в семейството му и той се оказа най-талантливият. Той успя да направи специален принос в теорията за структурата на атома.

Първоначални представи за строежа на атома
Трябва да се отбележи, че преди да бъде извършен известният експеримент на Ръдърфорд за разсейването на алфа частици, доминиращата идея по това време за структурата на атома беше моделът на Томпсън. Този учен беше сигурен, че положителният заряд равномерно запълва целия обем на атома като цяло. Отрицателно заредените електрони, според Томпсън, са като включвания в него.
Предпоставки за научната революция
След като завършва училище, Ръдърфорд, като най-талантливия ученик, получава стипендия от 50 паунда за по-нататъшно образование. Благодарение на това успява да отиде в колеж в Нова Зеландия. Освен това младият учен полага изпити в университета в Кентърбъри и започва сериозно да се занимава с физика и химия. През 1891 г. Ръдърфорд прави първия си доклад на тема "Еволюцията на елементите". В него за първи път в историята е посочена идеята, че атомите са сложни структури.
Тогава в научните среди доминира идеята на Далтън, че атомите са неделими. За всички, които заобикаляха Ръдърфорд, идеята му изглеждаше като пълна лудост. Младият учен трябваше постоянно да се извинява на колегите си за своите "глупости". Но след 12 години Ръдърфорд все пак успява да докаже своята теза. Ръдърфорд има шанс да продължи изследванията си в Кавендишката лаборатория в Англия, където започва да изучава процесите на йонизация на въздуха. Първото откритие на Ръдърфорд са алфа и бета лъчите.
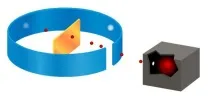
Опитът на Ръдърфорд
Накратко откритието може да бъде описано по следния начин: през 1912 г. Ръдърфорд, заедно със своите помощници, провежда известния си експеримент - алфа частици се излъчват от оловен източник. Всички частици, с изключение на тези, които се оказаха абсорбирани от олово, се движеха по инсталирания канал. Тесната им струйка падаше върху тънък слой фолио. Тази линия беше перпендикулярна на листа. Експериментът на Ръдърфорд върху разсейването на алфа частици доказа, че тези частици, които преминават през лист фолио през и през, причиняват така наречените сцинтилации на екрана.
Този екран беше покрит със специално вещество, което започваше да свети, когато алфа частиците го удариха. Пространството между слоя златно фолио и екрана беше изпълнено с вакуум, така че алфа частиците да не се разпръскват във въздуха. Такова устройство позволи на изследователите да наблюдават частици, разпръснати под ъгъл от около 150°.
Ако фолиото не се използва като препятствие пред лъча на алфа-частиците, тогава на екрана се образува светъл кръг от сцинтилации. Но щом пред лъча им беше поставена бариера от златно фолио, картината се промени драматично. Светкавици се появиха не само извън този кръг, но и от противоположната страна на фолиото. Експериментът на Ръдърфорд върху разсейването на алфа частици показа, че повечето от частиците преминават през фолиото без забележими промени в траекторията на движение.
В този случай някои частици бяха отклонени под доста голям ъгъл и дори изхвърлени назад. За всеки 10 000 частици, свободно преминаващи през слоя златно фолио, само една се отклонява под ъгъл над 10 ° - по изключение една от частиците се отклонява под такъв ъгъл.

Причината, поради която алфа частиците са били отклонени
Това, което опитът на Ръдърфорд изследва и доказва в детайли, е структурата на атома. Тази ситуация показваше, чече атомът не е непрекъснато образувание. Повечето от частиците преминават свободно през фолиото с дебелина един атом. И тъй като масата на алфа-частицата е почти 8000 пъти по-голяма от масата на електрона, последният не би могъл да повлияе значително на траекторията на алфа-частицата. Това може да се направи само от атомното ядро - тяло с малки размери, притежаващо почти цялата маса и целия електрически заряд на атома. По това време това е значителен пробив за английския физик. Опитът на Ръдърфорд се счита за една от най-важните стъпки в развитието на науката за вътрешната структура на атома.
Други открития, направени в процеса на изучаване на атома
Тези изследвания се превърнаха в пряко доказателство, че положителният заряд на атома е вътре в неговото ядро. Тази зона заема много малко пространство в сравнение с интегралните си размери. В такъв малък обем разсейването на алфа частици се оказа много малко вероятно. И онези частици, които преминават близо до областта на атомното ядро, изпитват резки отклонения от траекторията, тъй като силите на отблъскване между алфа-частицата и атомното ядро са много мощни. Експериментът на Ръдърфорд върху разсейването на алфа частици доказа вероятността алфа частица да удари ядрото директно. Вярно, вероятността беше много малка, но все пак не равна на нула.
Това не беше единственият факт, който опитът на Ръдърфорд доказа. Накратко, структурата на атома е изследвана и от неговите колеги, които правят редица други важни открития. С изключение на доктрината, че алфа частиците са бързо движещи се хелиеви ядра.
Ученият успя да опише структурата на атома, в която ядрото заема малка част от целия обем. Неговите експерименти доказват, че почти целият заряд на атома е концентриран вътре в неговото ядро. В този случай, както случаите на отклонение на алфа частици, така и случаите на техния сблъсък ссърцевина.

Експериментите на Ръдърфорд: ядрен модел на атома
През 1911 г. Ръдърфорд, след многобройни изследвания, предлага модел на структурата на атома, който той нарича планетарен. Според този модел вътре в атома се намира ядро, което съдържа почти цялата маса на частицата. Електроните се движат около ядрото по същия начин, както планетите около слънцето. От тяхната съвкупност се образува така нареченият електронен облак. Атомът, от друга страна, има неутрален заряд, както показа експериментът на Ръдърфорд.
Структурата на атома по-късно се интересува от учен на име Нилс Бор. Именно той финализира учението на Ръдърфорд, тъй като преди Бор планетарният модел на атома започва да се сблъсква с трудности за обяснение. Тъй като електронът се движи около ядрото по определена орбита с ускорение, рано или късно той трябва да падне върху ядрото на атома. Но Нилс Бор успява да докаже, че законите на класическата механика вече не важат вътре в атома.