Електронна структура на атомите, диаграма на енергийните нива, валентни електрони
За да опишат състоянието на електрон в атом, в допълнение към квантовите числа, те използват:
- диаграми на нивото на атомната енергия;
- електронни формули или конфигурации.
Диаграма на енергийните нива
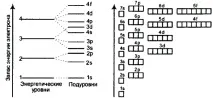
Фигурата показва диаграмата на нивата на атом, която може да се използва за описание на електроните на всеки атом.
Енергийните нива на атом (електронни облаци, образуващи електронни атомни слоеве) са обозначени с числа 1, 2, 3, 4.
Енергийни поднива на атом (енергийни нива, характеризиращи енергията на свързване на електрон с атомно ядро) се означават с буквите s, p, d, f.
Енергийните поднива могат да бъдат показани като квантови клетки (фигурата вдясно): свободни (празна клетка); частично запълнен (една вертикална стрелка, сочеща нагоре или надолу, показваща несдвоен електрон); напълно запълнени (две вертикални различно насочени стрелки, обозначаващи сдвоени електрони).
Електронна формула на атома
Всичко на диаграмите на енергийните нива е доста ясно и визуално, но тромаво. Използвайки електронната конфигурация, диаграмата може да бъде изразена в един кратък ред.
Помислете за въглероден атом, който има две енергийни нива само с 6 електрона (2 отвътре и 4 отвън):
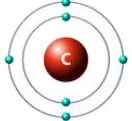
Фигурите по-долу показват примери за електронни формули на въглеродни и натриеви атоми (модел на електронната обвивка) и тяхното графично представяне:
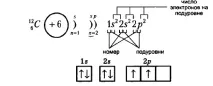
В електронната конфигурация името на орбиталата на енергийното ниво е посочено в горния индекс на коетое броят на електроните, разположени в тази орбитала.
| Сумата от числата, които са горни индекси, е равна на поредния номер на атома, т.е. броя на електроните в атома. |
Електронната обвивка на атома се формира съгласно следните принципи:
- принцип на минимална енергия - първо се запълват орбиталите с най-ниска енергия (най-близки до атомното ядро): 1s; 2s; 2p; 3s; 3p; 4s (3d); 4p; 5s (4d); 5p; 6s(4f)(5d); 6p; 7s;
- Принцип на Паули - в една атомна орбитала не могат да бъдат повече от 2 електрона с противоположни спинове (сдвоени електрони);
- Правило на Хунд - атомните орбитали са запълнени по такъв начин, че сумата от техните завъртания да е максимална.
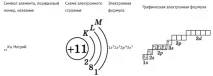
Например електронната формула за хлор е: 1s 2 2s 2 2p 6 3s 2 3p 5 .
Поредният номер на хлора в таблицата е 17. Това означава, че хлорният атом съдържа 17 протона и 17 електрона. Тоест трябва да поставим 17 електрона на диаграмата (според правилата).
Както бе споменато по-горе, схематично електронът е показан като стрелка. Ако има два електрона в орбиталата, те се показват като две различно насочени стрелки (електрони с различни спинове).
- Първо, запълваме най-ниското енергийно ниво: 1s орбитала. Има 2 електрона върху него.
- Следващите 2 електрона заемат 2s орбитала.
- Следващото енергийно ниво: 2p орбитала - 6 електрона.
- Следващите 2 електрона са 3s орбитала.
- Останалите 5 електрона са разположени в 3p орбитала, образувайки две спинови двойки (последният електрон няма двойка).
Така че диаграмата на енергийните нива за хлор ще изглежда така:
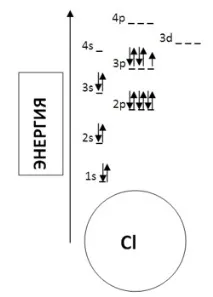
Внимателен читател най-вероятно е забелязал, че редът на запълване на електронните енергийни поднива в атомите е донякъде нарушен, например първо се запълва поднивото 4s и едва след това 3d. Това нарушение се обяснява справилото на Клечковски, което гласи, че електроните запълват атомните нива (поднива) във възходящ ред на сумата (n + l), ако сумите на главните и орбиталните квантови числа са равни, запълването става в реда на нарастване на n (вижте Квантовомеханичния модел на структурата на атома).
- За подниво 4s: n+l = 4+0 = 4;
- За 3d подниво; n+l = 3+2 = 5.
Поднива 3d, 4p, 5s имат равни суми n+l=5, така че запълването върви във възходящ ред на основното квантово число: 3d→4p→5s.
Правилото на Клечковски има редица изключения, когато поднива, близки едно до друго, се различават леко по енергия, в който случай електронът има тенденция да заема подниво с по-ниска енергия, дори и да е "покриващо", докато "долното" ниво остава незапълнено. Например 5d 1 се попълва преди 4f.
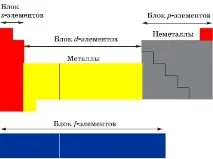
Класификация на химичните елементи според структурата на техните атоми:
- s-елементи (14): електроните запълват s-поднивото на външното ниво - водород, хелий + първите 2 елемента от всеки период;
- p-елементи (30): електроните запълват p-поднивото на външното ниво - последните 6 елемента от всеки период;
- d-елементи (32): електроните запълват d-поднивото на второто ниво отвън - елементи на интеркаларни декади с големи периоди, които са между s- и p-елементите;
- f-елементи (28): електроните запълват f-поднивото на третото ниво отвън - лантаниди и актиниди.
Валентни електрони
По-рано казахме, че атомът е неутрално заредена частица, тъй като броят на електроните и протоните в него е еднакъв. Въпреки това, електроните в най-външните орбитали са слабо привлечени от положителните протони в ядрото на атома. Следователно атомите на елементите са способни да отдават и прикрепват електрони.
| Електроните, разположени на външното непълно енергийно ниво, се наричат валентни електрони. Вижте Валентност за подробности. |
ТРЯБВА ДА ЗНАМ!Валентните електрони включват външните електрони плюс тези пред-външни електрони, чиято енергия е по-голяма от тази на външните.
Ако харесвате сайта, ще бъдем благодарни за популяризирането му :) Кажете на приятелите си за нас във форума, блога, общността. Това е нашият бутон:
Код на бутона: