ГЕОМЕТРИЯ НА МОЛЕКУЛИТЕ
Геометрията на молекулата се разбира като пространственото разположение на атомите, т.е. дължините на връзките и ъглите между тях. Експериментално формата (или геометрията) на молекулите се изучава чрез методите на рентгеновия анализ на кристалите и електронната дифракция.
За да обсъдим въпросите за пространствената структура на молекулите, е важно да разберем значението на следните термини.
Молекулата е електрически неутрална частица, състояща се от два или повече ковалентно свързани атома.
Карбокатион (карбений - труп от ковалентно свързани атоми, съдържащ положително зареден въглероден атом, напр.
Карбанионът е група от ковалентно свързани атоми, съдържащи отрицателно зареден въглероден атом, напр.
Свободният радикал е атом или група от атоми, които съдържат несдвоен електрон, като или
Дължината на връзката е средното разстояние между ядрата на ковалентно свързаните атоми. Използва се средната стойност, защото атомите непрекъснато осцилират, ту се приближават, ту се отдалечават един от друг.
Ъгъл на свързване - средната стойност на ъгъла между две ковалентни връзки. Поради вибрациите на атомите в молекулата, стойността на ъгъла във всеки даден момент може да се различава леко от средната.
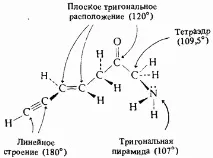
За органичната химия три вида разположение на атомите около въглероден атом са от голямо значение:
Всички ъгли на връзката в молекулата на метана са 109,5°. Тази подредба на атомите се нарича тетраедрична и е характерна за всички съединения, в които има въглеродни атоми, свързани с четири прости връзки.
Формалдехидът е плоска молекула. Ъглите на свързване в него са по 120°. Тази геометрия е характерна за всички молекули, които включват въглероден атом, свързан с една двойна и две единични връзки, като например в молекулата на етилена.
Трябва да се отбележи, че стойносттаъглите на връзката могат леко да варират в различните молекули. Тези разлики се определят от размера на атомите, свързани с въглеродния атом. Например в молекулата на дихлорометан ъгълът на свързване между връзките е малко по-голям, отколкото между връзките.Това се обяснява с големия размер на хлорния атом в сравнение с водородния атом. Ъглите обаче са близки до стандартната стойност от 109,5° и тетраедричната конфигурация се запазва.
Третият тип молекулна форма е илюстрирана от молекулата на ацетилена. Структурата на ацетилена е линейна, а ъглите на свързване са 180 ° всеки. Тази геометрия е типична за всички въглеродни атоми, свързани с една тройна и една единична връзка.
Кислородните и азотните атоми често се срещат в органичните съединения. В тези случаи ъглите на свързване са близки до тетраедричните. Неорганичните съединения на кислорода и азота са показани по-долу:
Приблизително същата геометрия се запазва в органичните съединения на кислорода и азота, независимо от сложността на структурата и
молекулен размер. Една от тези молекули и конфигурацията на атомите в нея са показани по-долу:
Формули, в които пространствената структура на молекулите е показана с помощта на клинове, плътни и пунктирани линии, се наричат стереохимични формули.