Хидрогениране на халоалкани
Каталитичното хидрогениране на халоалкани в присъствието на паладий дава алкани.
Цинкът в солната киселина и натрият в алкохола също могат да се използват за намаляване на халоалканите. Йодоалканите могат да бъдат редуцирани чрез нагряване в запечатана ампула с йодоводород.
Декарбоксилиране на карбоксилни киселини
Когато соли на карбоксилни киселини и алкални или алкалоземни метали се нагряват с натриев или бариев хидроксид, CO2 се елиминира и се образува алкан.
Тази реакция недвусмислено протича само за натриев ацетат, в случай на други соли се образуват странични продукти.
Синтез на Колбе
По време на електролизата на натриеви и калиеви соли на карбоксилни киселини се образуват въглеводороди със симетрична структура.
На първия етап се извършва анодно окисление на киселинни аниони до RCOO· радикали, които отделят CO2 и след това се димеризират. На катода се образуват водород и хидроксид на алкални метали.

Метод на Фишер-Тропш
Каталитичното хидрогениране на въглероден окис протича в присъствието на катализатор, съдържащ кобалт или желязо, с образуването на смес от алкани с малко молекулно тегло.
СТЕРЕОИЗОМЕРИЯ. ЕНАНТИОМЕРИЯ
Енантиомери. Хиралност. Хирални условия
Наред със структурните изомери има и пространствени изомери в серията алкани. Това може да бъде представено чрез примера на 3-метилхексан.
Въглеродният атом, обозначен като C*, е свързан с четири различни групи. В този въглеводород, с еднакъв ред на свързване на атомите, алкиловите групи могат да бъдат различно разположени в пространството около С* въглеродния атом. Има няколко начина за изобразяване на пространствени изомери в равнина (фиг. 2.1, 2.2).

Фиг. 2.1. Триизмерно изображение с помощта на "клинове"

Фиг. 2.2. Проекционни формули на Фишер
На Фигура 2.2 С* въглеродният атом е в центъра, хоризонталната линия показва връзката между С* въглерода и групите, изпъкнали пред чертожната равнина, а вертикалната линия показва връзката между С* атома и групите, разположени зад чертожната равнина. Проекциите на Fisher могат да се въртят само в чертожната равнина и само на 180 градуса, а не на 90 градуса или 270 градуса. Тези формули представляват две различни съединения. Те се различават една от друга по същия начин като предмет и неговия огледален образ или като лява и дясна ръка. Лявата и дясната ръка са два обекта, много подобни един на друг, но е невъзможно да се комбинират (да не се сложи лявата ръкавица на дясната ръка), което означава, че те са два различни обекта.
Една молекула има хиралност, ако няма равнина на симетрия. Има редица структурни елементи, които могат да направят една молекула неидентична на нейния огледален образ. Най-важният от тях е хиралния въглероден атом.
Молекулата на 2-метилхексан няма равнина на симетрия и следователно може да съществува под формата на енантиомери (виж фиг. 2.1).
Молекула, в която две или повече идентични групи са прикрепени към въглероден атом, има равнина на симетрия и следователно няма хиралност, тъй като молекулата и нейният огледален образ са идентични. Такива молекули се наричат ахирални.
Например изопентанът не може да съществува като енантиомери и няма хиралност (Фигура 2.3).

Фиг. 2.3. Молекулата на изопентана е ахирална3
Друг структурен елемент, който прави една молекула способна да съществува като енантиомери, са хиралните алени. Незаместена аленова (пропадиенова) молекулаахирален.
В аленова молекула две равнини, съдържащи две крайни CH2 метиленови групи, са взаимно перпендикулярни.
В резултат на това заместените алени от типа XYC=C=CXY нямат равнина на симетрия и могат да съществуват като енантиомери.

Друг пример биха били бифенилови производни, в които заместителите в орто позициите са достатъчно големи, за да предотвратят свободното въртене. Те могат да съществуват като енантиомери въпреки липсата на хирални атоми. Този тип изомерия се наричаатропизомерия.

Не винаги съединения, които нямат равнина на симетрия, имат хиралност и могат да бъдат разделени на енантиомери. Например в метилетиламин CH3(C2H5)NH азотът има четири различни заместителя: H, CH3, C2H5 и несподелена двойка електрони, които лежат във върховете на тетраедъра.
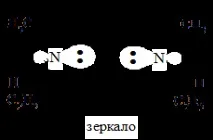
Изглежда, че такова съединение трябва да съществува под формата на енантиомери и да проявява оптична активност. Въпреки това, невъзможността да се раздели този амин на енантиомери е причинена от конфигурационната нестабилност на метилетиламин, един енантиомер бързо се превръща в друг.

Обръщането на пирамидата на метилетиламин I → II и II → I се извършва чрез планарен ахирален азотен атом. Това означава, че метилетиламинът се състои от еквимолекулна смес от енантиомери, следователно не е разделен на отделни енантиомери и не проявява оптична активност.
Ако обаче в този амин се образува връзка поради несподелената електронна двойка, която не позволява на молекулата да „избяга“, тогава частицата става конфигурационно стабилна.
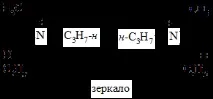
Метилетилпропиламониевият катион съществува като енантиомери.
Следователно, връзки, които нямат равнина на симетрия,могат да съществуват като енантиомери и да проявяват оптична активност само ако са конфигурационно стабилни.
Енантиомерите проявяват същите физични свойства с изключение на едно. Например, молекулата 2-бромобутан съществува като два енантиомера. Те имат еднаква точка на кипене, точка на топене, плътност, разтворимост, индекс на пречупване. Един енантиомер може да бъде разграничен от друг по знака на въртене на равнинно поляризирана светлина. Енантиомерите завъртат равнината на поляризираната светлина под същия ъгъл, но в различни посоки: единият - по часовниковата стрелка, другият - под същия ъгъл, но обратно на часовниковата стрелка.
Енантиомерите имат еднакви химични свойства, скоростта на тяхното взаимодействие с реагенти, които нямат хиралност, е еднаква. В случай на реакция с оптически активен реагент скоростите на реакцията на енантиомерите са различни. Понякога те се различават толкова много, че реакцията на даден реагент с един от енантиомерите изобщо не протича.