Йонни иковалентен характер на връзката
Йонният и ковалентният характер на връзката са двата крайни случая на много реални химични връзки, които в действителност най-често имат междинен характер. На фиг. 2.11 схематично показва тези два крайни случая, както и междинни случаи между тях - йонна връзка с частично ковалентен характер и полярна ковалентна връзка: * b (с частично йонен характер). По-пълна картина на двата типа ограничаващи връзки се дава от карти на електронна плътност, подобни на тези, показани на фиг. 2.12 за натриев хлорид и водородна молекула. Но дори и за натриевия хлорид е трудно да се забележи слабият ковалентен характер на връзката, който се разкрива от правоъгълната форма на външните контури. Не са намерени изкривявания на картата на електронната плътност на водородната молекула. Следователно химическата връзка в молекулата на водорода е чисто ковалентна връзка (фиг. 2.12).
представят йонния и ковалентния характер на връзката като резонансна структура, образувана от няколко канонични форми.
Най-простите многоатомни йони, като тези, обсъдени по-горе, понякога се наричат ковалентни йони. Те са частен случай на голяма група йони, наречени комплексни йони. Комплексният йон се състои от централен атом, заобиколен от други атоми, йони или групи от атоми, така наречените лиганди. Лигандите са свързани с централния атом чрез координационни връзки. Най-важните примери за комплексни йони са йони на преходни метали като [Cu(NH3)J2+ или [CoCl4]2". Такива йони се обсъждат подробно в Глава 14.

a Натриев хлорид NaCI
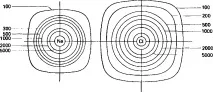
b Молекула на водорода

Ориз. 2.12. Карти на електронната плътност. Цифрите показват електронната плътност.