Как седи шапката Структурната биология изучава процеса на ацетилиране
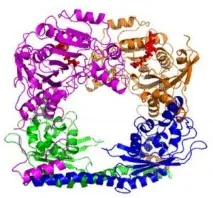
Хистон -ацетилтрансферази (HATs) са ензими, които епигенетично модифицират експресията нагени. Как променят целта си зависи от формата им. Тази пръстенна структура се формира от две Rtt109 ацетилтрансферази (показани в лилаво и златно) и два Vps75 шаперона (син и зелен), протеини, които придружават ензимите до тяхната цел и отчасти определят размера на дупката, образувана по време на образуването на пръстена. Коя част от мишената е модифицирана, определя формата на пръстенния комплекс, образуван, когато HAT се свърже с горната част на хистоновия протеин. Други шаперони могат да помогнат на Rtt109 да модифицира други части на хистона. (Снимка: Ronen Marmorstein)
Чрез разработването на епигенетика, нова област на биологията, която описва как експресията нагени се регулира, без да се променя саматаДНК, учените дешифрират механизмите, чрез които ензимите действат върху околнитеДНКпротеини.
Според ръководителя на изследването Ронен Марморстейн, д-р, професор и директор на Програмата за генна експресия и регулиране на Wistar Institute, две копия на Rtt109 взаимодействат с две копия напротеин -шаперон, за да образуват пръстенна структура.
„Пръстенът се намира върху хистона като ореол и ние открихме, че това е типът шаперон, който определя какъв ефект има ензимът [ацетилтрансфераза] върху хистона, диктувайки точното място на ацетилиране“, обяснява професор Марморщайн. "Структурата е добра моделна система за регулиране на ацетилирането на протеини и ни казва нещо ново за биологията на този ензим, Rtt109."
Ацетилирането добавя ацетилова група, малкахимическа структура, до лизин, една от аминокиселините, които изграждат този протеин. Rtt109 ацетилтрансферазата ацетилира всеки от трите хистонови лизина и кой лизин претърпява модификация се определя от това кой шаперон придружава Rtt109 до мястото на реакцията. Като се има предвид, че хистоните са жизненоважни ДНК-асоциирани протеини, модифицирането на един лизин в една част от тяхната структура може да има дълбок ефект върху "поведението" на този хистон, например, правейки определен набор от гени четим.
В статията Marmorstein и колегите показват как Rtt109 взаимодейства със специфиченшаперон, Vps75. Въпреки това, Rtt109 също взаимодейства с друг шаперон, Asf1, което очевидно позволява на Rtt109 да модифицира лизина на хистоновата молекула в други позиции, влияейки по различен начин как този хистон взаимодейства с ДНК, което от своя страна променя биологичните свойства на клетката.
Това изследване е първото, което показва, че две молекули Rtt109 взаимодействат с две молекули Vps75 шаперон, за да образуват пръстен. Учените получили кристали от протеиновия комплекс и с помощта на метода на рентгеновата кристалография „видяли“ структурата му въз основа на анализа на отражението от рентгеновия кристал. Мощният рентгенов източник Advanced Photon Source на Argonne National Laboratory им позволи да определят структурата на протеиновия комплекс на атомно ниво - с разделителна способност от 2,8 ангстрьома (2,8 десетмилиардни от метъра), което е по-малко от разстоянието между отделните стъпала на ДНК стълбата.

Проф. Ронен Марморщайн, д-р, директор на Програмата за експресия и регулиране на гени в Wistar Institute. (Снимка: wistar.org)
Лабораторията на проф. Марморщайн започна да изучава хистонови ацетилтрансферази преди повече от десетилетие и няколко широкомащабни проучвания показаха, че ацетилирането е присъщо на повече от 2000 протеина, а не само на хистони. Според Марморщайн съществува цяла мрежа от взаимодействия, пряко свързани с ацетилирането на протеини - друг слой на сложност в една вече сложна област.
„Видяхме, че много различни протеини по няколко различни пътя се подлагат на ацетилиране, което оказва влияние върху метаболизма на РНК, контрола на клетъчния цикъл, развитието на рак и множество други биологични аспекти. Изглежда, че протеиновото ацетилиране има много по-широко биологично значение, отколкото се смяташе преди“, каза проф. Марморщайн. „В много отношения това е подобно на това, което видяхме през последните години в изследването на протеин кинази и клетъчно сигнализиране. Научихме, че хистоновите ацетилтрансферази и вероятно други протеинови ацетилтрансферази са регулирани по подобен начин. Те имат много дълбок ефект върху клетката, но това е напълно нова област на науката. Как всичко работи е голяма черна кутия, която възнамеряваме да отворим.
Yong Tang, Marc A. Holbert, Neda Delgoshaie, Hugo Wurtele, Benoît Guillemette, Katrina Meeth, Hua Yuan, Paul Drogaris, Eun-Hye Lee, Chantal Durette, Pierre Thibault, Alain Verreault, Philip A. Cole, Ronen Marmorstein. Структура на комплекса Rtt109-AcCoA/Vps75 и последици за медиираното от шаперон ацетилиране на хистони