Контролът на клетъчния цикъл като основа на химиотерапията
Всички живи същества имат вродена способност да се възпроизвеждат и спиратразмножаването поради различни причини. Очевидно контролът се осигурява от неизвестен механизъм за обратна връзка, вероятно поради контактния феномен (с голямо натрупване на клетки). Въз основа на познаването на принципите на клетъчния растеж са разработени методи за химиотерапия (XT); използвани са разликите в характеристиките на растеж на нормални и злокачествени тъкани.
Нарастващите тъканни популации обикновено също са пасивнив зряла възраст, но за разлика от статичните популации, те запазват способността си бързо да се размножават в отговор на стрес или нараняване. Типични примери за растящи тъкани са хепатоцитите и ендотелиумът. Обновяващите се тъкани са най-податливи на увреждане, причинено от химиотерапевтични лекарства.
При злокачествен растеж клетките не спиратда се възпроизвеждат, когато достигнат критична маса. Този нерегулиран растеж е резултат от комбинация от загуба на контрол върху клетъчния цикъл и увреждане на нормалните апоптотични механизми. Въпреки неконтролирания растеж, злокачественото клетъчно делене не става по-бързо от нормалното клетъчно делене.
По принципрастежът на туморитесе характеризира с динамиката на Gompertz: докато туморът расте, времето, необходимо за удвояване също постепенно се увеличава. По този начин очевидно в ранните етапи туморните клетки растат експоненциално, но с нарастването на туморната маса времето за удвояване прогресивно се увеличава, въпреки че може да варира значително при хората. Например, ембрионалните тумори и някои лимфоми имат относително кратко време на удвояване (20-40 дни), докато аденокарциномите и плоскоклетъчните карциноми имат относително дълго време на удвояване (50-150 дни).дни).
Дадени са три обяснения затова удължено време на удвояване: 1) увеличено време на клетъчния цикъл (време от една митоза до следващата); 2) намаляване на броя на клетките, участващи в процеса на делене в тумора; 3) увеличаване на смъртта на туморни клетки поради недостатъчно количество хранителни вещества и кръвоснабдяване.

Моделът на Gompertzе от съществено значение за разбирането на прогресията на злокачествените неоплазми. Първо, като правило метастазите имат по-кратко време на удвояване от първичното място. Ако се приеме, че експоненциалният растеж на злокачественото заболяване възниква рано и злокачествената неоплазма произхожда от една клетка, тогава са необходими приблизително 20 удвоявания, за да може диаметърът на възела да достигне 1 mm. Тумор с диаметър 5 mm (размер, който позволява да се разпознае тумор на рентгенова снимка) претърпя 27 удвоения.
От това следва, че за да достигнетуморътразмер от 1 cm, са необходими 30 удвоения; би било добре, ако практикуващият идентифицира такава "ранна" лезия. Въпреки това, тази "ранна" лезия вече е претърпяла 30 дублирания, вероятно със значителна промяна в ДНК. Въз основа на това наличните в момента клинични методи често позволяват разпознаването на злокачествени новообразувания само в късен стадий на техния растеж и е вероятно метастатичната форма на заболяването да се развие преди клиничното откриване на първичния фокус.
ДругЗаключението, направено оттази информация за кинетиката: в късните етапи на растежа на тумора малък брой удвоявания на туморната маса има значително влияние върху размера на тумора и състоянието на пациента. След като туморът стане осезаем (1 см в диаметър - 30 удвоения), само 3 удвоявания ще доведат до голям тумор (8 см в диаметър).
Моделът Gompertzима клинични последици, което е довело до много проучвания за ефективността на химиотерапията (XT). Тъй като туморът реагира на лечението (т.е. свива се по размер), предполага се, че времето за удвояване е намаляло поради големия брой клетки, влизащи в клетъчния цикъл. В резултат на това процентът на метаболитно активните клетки се увеличава, следователно се повишава чувствителността на популацията от злокачествени клетки към фазово-специфични лекарства.
Това доведе до използването следфаза на неспецифични лекарства(напр. циклофосфамид), които намаляват туморната маса, специфични за фазата (напр. метотрексат). Въпреки че такива последователни комбинации са теоретично привлекателни, нито една от тях не показва значителни резултати в клиничните изпитвания. Друго следствие от концепцията за динамиката на растежа на Gompertz е, че се очаква метастазите да бъдат по-чувствителни към химиотерапия (XT) като цяло и към фазово-специфични лекарства в частност, отколкото първичния тумор, от който произхождат.
Колкото по-малък еразмерът на метастатичното огнище, толкова по-голяма е разликата в неговата чувствителност в сравнение с първичния тумор. Следователно резистентността на първичния тумор към предписания лекарствен режим не винаги предсказва отговора на метастазите към същия режим на химиотерапия (XT).

Адекватното използване на лекарстваза лечение на злокачествени новообразувания трябва да доведе до селективно унищожаване на туморни клетки. Това твърдение се основава на хипотезата за "клетъчната смърт", която е описана за първи път от Skipper et al. Следните четири принципа са разработени върху модела на левкемия L1210. 1. Степента на оцеляване на животни със злокачествено новообразувание е обратно пропорционална на броя на злокачествените клетки. 2. Една клетка е способна да се възпроизвежда и в крайна сметка ще доведе до смъртта на гостоприемника. 3. За повечето лекарства има ясна връзка между дозата и способността им да убиват туморни клетки. 4. Предписаната доза от лекарството унищожава определена част от клетките, а не определен брой от тях, независимо от наличния брой клетки.

Четвъртият и най-важенпринциппредполага, че химиотерапевтичните лекарства действат според динамиката от първи ред, т.е. те унищожават определена част от клетките, а не определен брой от тях. Тази концепция е важна за противораково лечение. Една доза противораково лекарство може да намали броя на туморните клетки с 10 2 -10 4 пъти. При общ туморен товар от 10 12 клетки (1 kg), една доза ще може да унищожи голям брой клетки, но няма да доведе до излекуване.
По този начин са необходими периодичникурсове на химиотерапия(XT), за да се постигне количеството клетъчна смърт, необходимо за пълното премахване на тумора. На практика, за да се унищожат напълно туморните клетки, е необходимо: • да се увеличи общият бройдозата на лекарството или лекарствата до максималната поносимост; • започнете лечение, когато броят на клетките е достатъчно малък, за да унищожи тумора с рационални общи дози лекарства.
От тазихипотезалогично се заключава, че перспективата за пълно възстановяване е максимална в ранните стадии на заболяването. В миналото химиотерапията (ХТ) се използваше предимно за лечение на дисеминирано злокачествено заболяване, като при локално разпространение на процеса се избираше хирургия и/или ЛТ. Въпреки това, тази концепция за "логаритмична смърт" разумно оправдава принципите на адювантната XT, които предполагат съществуването на неоткриваема клетъчна маса от 10 1 до 10 4 клетки след първична операция, която е способна да причини рецидив на тумора. Такъв малък тумор е особено чувствителен към химиотерапия (XT).
За по-доброразбиране на клетъчната кинетикае необходимо да се вземе предвид клетъчният цикъл. Всички клетъчни деления се предшестват от натрупването на необходимите вещества за репликация. Времето, необходимо на клетката да завърши един цикъл на растеж и клетъчно делене, се нарича време на генериране. Има пет основни фази. Фазата G1 (от английски gap - празнина, прекъсване) обикновено отнема 4-24 часа.Ако тази фаза продължи по-дълго, клетката обикновено преминава във фаза G0 или почивка. Фаза S е фазата на синтеза на ДНК и обикновено продължава 10-20 часа.Фаза G2 се счита за предмитотична, която продължава 2-10 часа.
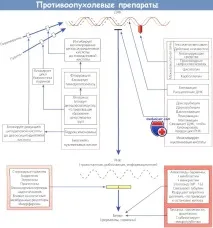
И накрая, фазатаM, когато митозата настъпва директно, отнема 0,5-1 ч. Туморът няма по-бързо време за генериране, но има повече клетки в активния стадий на репликация, отколкото в нормалните тъкани. Нормалните тъкани имат огромен брой клетки във фаза G0, от които бавно преминават към делене или излизат от цикъла.
Очевидно някоихимио лекарствазасягат определени фази от клетъчния цикъл. Смята се, че алкилиращите агенти засягат всички фази от G0 до митозата. Те се наричат фазово-неспецифични агенти. Вероятно лекарства като хидроксиурея, доксорубицин (адриамицин) и метотрексат действат предимно във фазата S. Смята се, че блеомицинът действа във фазата G2, а винкристинът във фазата М. Тези лекарства се наричат фазово-специфични агенти, защото имат химиотерапевтичен ефект само върху клетки, които са в определена фаза от цикъла на клетъчно възпроизвеждане. Стероидите, флуороурацилът и цисплатинът имат подобни ефекти върху клетъчния цикъл на възпроизводство.
Теоретично, ако в една злокачествена неоплазматерапевтичните лекарствазасягат само клетките, които се делят, и повечето туморни клетки се делят, за разлика от клетките на нормалната тъкан, тогава правилните интервали между химиотерапевтичните лекарства и техните комбинации, които действат в различни фази на клетъчния цикъл, ще убият повече туморни клетки от нормалните. Кинетичните изследвания при хора и животни предполагат, че туморите, лекувани с XT, имат голяма част от клетки в пролиферираща фаза (напр. гестационен хориокарцином и лимфом на Бъркит).
Стадият на заболяването, а не общото тегло на тумора, се счита за най-важниятфактор при използване на RTили операция, но когато се използва XT, най-важният критерий е общото тегло на тумора. Когато обемът на тумора намалее, останалите туморни клетки могат да започнат активно да се делят (те преминават от G0 фаза към по-податливи клетки от цикъла на възпроизвеждане), като по този начин стават податливи на XT. Химио лекарствата, като RT, причиняват смъртклетки в съответствие с кинетиката от първи ред, т.е. популацията на туморни клетки намалява с определен процент, въпреки първоначалния брой клетки. Ако тежестта на тумора е малка, тогава могат да се прилагат по-малко цикли химиотерапия (XT). 1 mg тумор обикновено се състои от 10 6 клетки; 1 cm 3 - от 10 9 клетки. Смъртта на пациента, като правило, настъпва, когато туморът съдържа 10 12 клетки.