Квантовите постулати на Бор
Търсене в навигационен изглед
Квантовите постулати на Бор
Планетарният модел, създаден от Ръдърфорд, даде представа за това как работи атомът, но не успя да обясни защо атомът е стабилен. Това беше направено от датския теоретичен физикНилс Хенрик Дейвид Бор, който предложи квантовата теория на атома, която се основава на два постулата.
В модела на Ръдърфорд електроните се въртят около ядрото, подобно на планетите в слънчевата система около слънцето. Но според законите на класическата електродинамика, движейки се по кръг с постоянна скорост, електронът трябва да получи ускорение. А ускореното движение на заряда означава появата на променливо електромагнитно поле в пространството. Това означава, че въртящият се около атом електрон трябва непрекъснато да излъчва електромагнитни вълни. Но в този случай електронът много бързо ще изразходва цялата си енергия. Радиусът на орбитата му ще намалее и той ще се приближи до ядрото на атома, подобно на сателит, който се приближава до Земята. В крайна сметка той ще падне върху ядрото. Атомът ще престане да съществува. Всъщност атомът е стабилен и може да съществува много дълго време.
Бор стига до извода, че законите на класическата електродинамика не могат да бъдат приложени към процеси, протичащи вътре в атома. Тук е необходим различен подход. Вземайки за основа планетарния модел на Ръдърфорд, през 1913 г. той предлага два постулата, които стават основата на нова теория за атома.

Нилс Хенрик Давид Бор
Първият постулат на Бор
Атомът и атомната система могат да останат дълго време само в специални стационарни състояния, в които не излъчват и не поглъщат енергия, въпреки движението на заредените частици, които изграждат атома. Всяко от тези състояния отговаря на определеноенергияEn.
Този постулат се наричапостулат за стабилно състояние. Същността му е, че електроните в атома могат да се движат само по определени орбити, които се наричат стационарни. Намирайки се в такива орбити, електронът нито излъчва, нито поглъща енергия.
Трябва да се отбележи, че това твърдение противоречи на електродинамиката на Максуел. В крайна сметка, от нейна гледна точка, всеки движещ се заряд трябва да излъчва електромагнитни вълни. И тъй като се предполага, че електронът може да се движи във всяка орбита, броят на електронните орбити може да бъде безкраен. Според теорията на Бор един електрон може да се движи само в стационарна орбита, без да излъчва електромагнитни вълни. Ученият откри, че в такива орбитиъгловият момент на електрона, илиимпулсът, е кратен наквантоватаконстантата на Планки се определя по формулата:
v– скоростта на електрона в кръгова орбита;
r- радиус на електронната орбита;
ħ– квантовата константа на Планк. Тя се различава от константата на Планк, която се счита за основната константа на квантовата теория и свързва енергията на кванта на електромагнитното излъчване с неговата честота с 2π. ( ħ = h /2π ) ;
n= 1,2,3… - брой електронни орбити.
Електроните в атома, намиращи се в стационарни орбити, имат съвсем определени енергийни стойностиЕ1, Е2, Е3… Еn.
Вторият постулат на Бор
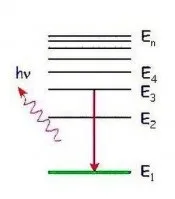
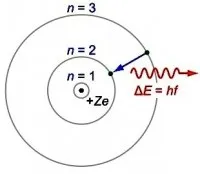
Излъчване на квант енергия от атом
Този постулат се наричаправило за честотата.
Когато един атом преминава от едно неподвижно състояние в друго, се излъчва или поглъща енергия.
Така че атомът не е в неподвижно състояниеизлъчва. Енергията се абсорбира или освобождава, когато електрон се движи от една стационарна орбита в друга. Излъчва се на порции, които се наричат кванти.
Това се потвърждава от формулата на Планк, която той извежда през 1900 г.:
къдетоħе константата на Планк;
v- честота на енергийно квантово излъчване.
В момента на излъчване или поглъщане електронът прескача от една разрешена орбита в друга. Този процес се нарича "квантов скок", защото електронът сякаш изчезва от една орбита и внезапно се появява отново в друга.
Електронът има най-ниска енергия, когато е в орбитата, най-близка до ядрото. И колкото по-далеч е тази орбита от ядрото на атома, толкова по-голяма ще бъде неговата енергия.
Когато един електрон се движи от далечна орбита към близка, той излъчва квант енергия. Ако се премести от близка орбита към далечна, тя поглъща енергия и енергията на атома се увеличава. Това се случва, когато атом например се сблъска с други частици или погълне квант светлина.
В момента на излъчване или поглъщане енергията на атома се променя. Стойността на тази енергияεе равна на разликата между енергиите на стационарните състояния на атома. Когато един атом преминава от стационарно състояниеmкъм състояниеn, квантовата енергия се определя по формулата:
къдетоѵе честотата на квантовата емисия.
Както можете да видите, в теорията на Бор честотата на квантовото излъчване зависи само от промяната в енергията на атома, което също противоречи на електродинамиката на Максуел.
Бор изчислява радиусите на стационарните орбити и енергията на електроните в тези орбити:
къдетоnе номерът на орбитата;
aе радиусът на орбитата на най-близкия електрон до ядрото на водородния атом, нареченрадиус на Бор.а= 5,3 10 -11м.
Като допълва теорията на Ръдърфорд с идеята за квантуване на орбитите на електроните, Бор не отхвърля законите на класическата физика. Той запази идеите за кръговото движение на електроните около ядрото под въздействието на силите на Кулон. Затова неговата теория често се нарича полукласическа.