Методи за производство на натриев нитрат
Натриевият нитрат се извлича от естествени находища и се произвежда по фабрични методи. В СССР има естествени находища на натриев нитрат в Централна Азия, Кавказ и Крим, но те нямат промишлена стойност 222-223.
В Чили (Южна Америка) има промишлено находище на натриев нитрат, където се добива.
Съдържанието на NaN03 в съдържащата селитра пръст на чилийското находище варира значително. Най-богатият на нитрати слой, наречен калиш, с дебелина 0,25-1,5m,разположен на дълбочина 0,5-2,5m отземната повърхност, обикновено съдържа от 15 до 65%, а понякога и до 95% NaN03. Типична е скала, съдържаща около 18% NaN03. В допълнение към NaN03, скалата съдържа различни количества NaCl, KN03, Na2S04, MgS04, CaS04 и др.
Извличането на селитра от калиев нитрат се извършва чрез противоточно горещо излугване и последваща кристализация при охлаждане на почти наситен разтвор. Полученият продукт съдържа 94–96% NaNOs и примеси от други соли. По-чиста (рафинирана) селитра, съдържаща 99-99,5% NaNO3, се получава чрез прекристализация.
Фабричните методи за получаване на натриев нитрат се основават на абсорбцията на азотни оксиди с разтвор на сода или на обменното разлагане на други нитрати с натриеви съединения или на катионния обмен.
Метод за получаване на NaN03 от NaCl и азотна киселина е патентован 224 (подобно на метода за получаване на KNOs, обсъден по-долу — вижте стр. 1229).
Най-простият начин за получаване на натриев нитрат - неутрализацията на азотна киселина със сода или сода каустик не се използва в промишлеността поради неикономичност. Най-често срещаният промишлен метод се основава на абсорбцията от алкали на азотни оксиди от азотни отработени газове от производството на азотна киселина.
Получаване на натриев нитрат чрез абсорбция на азотни оксиди с основи 225-230
Когато азотните оксиди се абсорбират от алкали, възникват следните реакции:
Разтворите, получени в резултат на алкална абсорбция на азотни газове (нитритно-нитратна луга), се преработват в натриев нитрат (фиг. 355). Съотношението между натриев нитрат и нитрит в получените течности зависи от температурата и степента на окисление на азотните газове 228. Приблизителният състав на "суровите" нитритно-нитратни разтвори (след алкална абсорбция): 3—5g/lNaHC03 и Na2C03; 2—4g/lNaCl; 850-820g/lH20.
Разтворът, филтриран върху филтърната преса, влиза в апарата-инвертор с периодично или непрекъснато действие, в който трансформацията (инверсията) на нитрита в натриев нитрат се извършва под действието на азотна киселина:
Азотните оксиди, образувани в резултат на инверсията, се отстраняват от разтвора чрез въздух, инжектиран в инвертора, и се изпращат за обработка в отдела за абсорбция на цеха за слаба азотна киселина. В края на процеса на инверсия разтворът се неутрализира с разтвор на сода. Новополученият разтвор, съдържащ 40-50% NaNO3 и имащ температура 40-60°C, се изпраща за изпаряване.
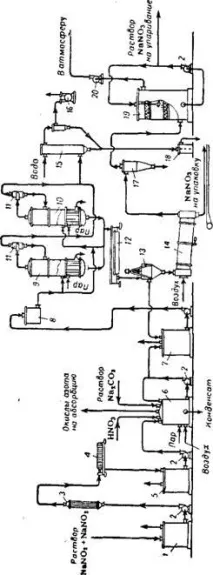
Предлага се инверсията на нитритни разтвори да се извършва в апарат за пяна - процесът протича с висока скорост и степента на инверсия достига 99,9% 231.
75%, докато разтворът съдържа 62% NaN03, останалата част от солта е в суспензия под формата на кристали. Тази суспензия от изпарителя навлиза в винтов кристализатор с водна риза, в който се получава допълнителна кристализация на солта при охлаждане от 90-93° до 40-45°. Кристалите NaN03 се отделят от разтвора вцентрофуга и се суши в сушилен барабан 232. Матерният разтвор от центрофугата се добавя към обърнатия разтвор, насочен към изпаряване.
За получаване на 1 g натриев нитрат (100% NaN03) се изразходват: 0,455 тона азотна киселина (100%), 0,03 тона сода, 2,5 тона пара (8 atm), 65 m3 вода, 120kW-hелектроенергия. Като производствени отпадъци се получават 0,38tазотни оксиди (по отношение на HN03), изпратени за абсорбция (на 1tNaN03).
Метод за преобразуване за получаване на натриев нитрат
Натриевият нитрат може да се получи чрез методи на обменно разлагане съгласно следните реакции:
Всяка от тези реакции има свои специфични характеристики. Така че, когато се извършва обменното разлагане между калциев нитрат и натриев сулфат, е необходимо да се въведе излишък от калциев нитрат в процеса, който частично навлиза в продукта и го прави хигроскопичен. Утаяването на гипса води до силно сгъстяване на реакционната маса; за да остане достатъчно подвижен, е необходимо след отделянето на гипса от него да се разреди с разтвор на натриев нитрат, т.е. част от разтвора да се върне в реактора. Скоростта на обменно разлагане зависи от температурата. Така че в този случай реакцията протича при 50° много по-бързо, отколкото при 70°; в рамките на 1hпри 50 °, преобразуването достига 96%, а при 70 ° само 11%.
Производство на натриев нитратпо методакатионен обмен
Интересно е разработването на нови методи за производство на калиеви и натриеви нитрати, които не изискват алкали. Тези методи включват получаване на натриев нитрат от NaCl и азотни оксиди, подобни наполучаване на калиев нитрат (стр. 1229), както и катионнообменния метод 233 > 234.
Процесът на получаване на натриев (или калиев) нитрат чрез метода на катионен обмен се състои от три основни етапа:
получаване на разтвор на Ca(N03)2;
катионен обмен и регенерация на катионита (обмяна на Car+ йони с Na+ йони);
Изпаряване на разтвор на NaNO3, кристализация на соли, центрофугиране, сушене и опаковане.
. Реакциите, протичащи в първите два етапа на процеса, могат да бъдат схематично изразени със следните уравнения: Ca(N03)2 + (катионобменник) № 2
Технология на минералните соли (торове, пестициди, индустриални соли, оксиди и киселини)
Получаване на хлорен диоксид от натриев хлорит
Когато натриевият хлорит взаимодейства с хлора, се образува натриев хлорид и се отделя хлорен диоксид: 2NaC102 + C12 = 2NaCl + 2 CIO2 Преди това този метод беше основният за получаване на диоксид ...
Схеми с двустепенна амонизация
На фиг. 404 показва диаграма на производството на диамонитрофосфат (тип TVA). Фосфорната киселина с концентрация 40-42,5% P2O5 от колектора 1 се подава от помпа 2 към резервоар под налягане 3, от който непрекъснато се ...
АМОНИЕВ СУЛФАТ
Физични и химични свойства Амониевият сулфат (NH4)2S04 е безцветни ромбични кристали с плътност 1,769 g/cm3. Техническият амониев сулфат има сивкаво-жълтеникав оттенък. При нагряване амониевият сулфат се разлага със загуба на амоняк, превръщайки се в ...