Мутации на вируса на хепатит В
Мутант(от латински mutare - променям) е ген, хромозома, организъм или популация, които се различават от съответния див тип по една или повече генетични промени - мутация. Мутацията е относително стабилна и наследена промяна в генетичния материал, която представлява биохимична промяна в кодон или физическа промяна в междухромозомните връзки. В съвременната научна литература доста често се описват мутации на HBV.
Установено е, чеHBVмутира по-често, отколкото се смяташе досега, тъй като неговата репликация изисква обратна транскрипция на прегенома на РНК, процес, който е силно предразположен към неправилно разчитане. Установено е, че тази вероятност е 2x10-4 базови замествания на място на година, което е с 4 порядъка по-високо от степента на мутация на други ДНК вируси, въпреки че не достига скоростта на мутация на РНК вирусите.
Наличието на дълги участъциделециипоказва наличието на други механизми на мутагенеза. Те могат да включват грешки при четене на други етапи на репликация, действието на клетъчната топоизомераза и генно снаждане с алтернативни донорни и акцепторни места. Мутациите могат също да са резултат от рекомбинация между коинфекциозни щамове. HBV мутациите не са ограничени до отделни ORF и се срещат във всички вирусни гени и регулаторни елементи.
Мутантите наHBV, изолирани от пациенти както с остра (фулминантна), така и с хронична инфекция, се разделят на 4 групи: генни мутанти на пре-ядро и ядро, генни мутанти на preS и S (повърхностни) протеини, генни мутанти на полимераза/обратна транскриптаза и генни мутанти на X. Доста често мутантите съществуват съвместно с вируси от див тип при един пациент. Всъщност слуги на инфекцията с изчезването на мутантни щамове на вирусатрябва да се разглежда като смесена инфекция с различна първоначална ДНК, взаимодействаща една с друга чрез транс-активиране и рекомбинация.
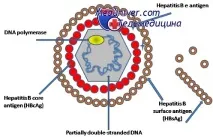
HBVмутанти бяха открити за първи път при пациенти с хроничен хепатит В, които имат вирусна ДНК, открита в кръвта им, но липсват серологични доказателства за настояща или минала инфекция (т.е. HBsAg и анти-HBs). Тъй като HBV може да персистира в тялото с години или дори десетилетия, мутациите могат да се натрупат и да станат клинично значими.
Основнитефактори, допринасящи за това натрупване, са: дълго време на вирусна персистенция, висока скорост на вирусна репликация (с освобождаване на до 1011 вирусни частици на ден в периферната кръв), имунен натиск и натиск от лекарствената терапия. Някои мутации могат да повлияят на спецификата на хода на инфекциозния процес, ефективността на диагностиката, профилактиката и лечението. Тези практически важни влияния позволяват да се въведе класификация на съответните механизми. По този начин намаляването на скоростта на отстраняване на вирусите от тялото от имунната система и увеличаването на резистентността към лекарствената терапия се наричат съответно "имунно бягство" и "терапевтично бягство".
Мутации в гени, кодиращи протеини на вирусната обвивка, могат да доведат до намаляване на способността на диагностичните системи да откриват вируса и дори до неговата пълна „неоткриваемост“ чрез методи, базирани на използването на антитела срещу дивия тип вирус („диагностично бягство“) или до неразпознаване от неутрализиращи антитела, предизвикани от ваксинацията
Точковитемутациив S-гена са от най-голям интерес за практическото здравеопазване, тъй като те могат да повлияят на имуногенността на HBsAg и особено на неговите детерминанти a, kкойто произвежда защитни антитела. За да се обясни как една мутация в една област на ген може да повлияе на структурата на два или повече отдалечени епитопа, беше предложен нов модел на големия хидрофилен регион (LHR) на S протеина.
Оригиналниятдетерминантенмодел на S протеина приема двуконтурна структура в областта на аминокиселинните остатъци 124-147 с дисулфидни мостове между аминокиселинни остатъци 124 и 137. В съответствие с новопредложения модел (36), който не отрича възможното присъствие на дисулфидни мостове, голямата хидрофилна област на протеин S (аминокиселинни остатъци 100-160 или 169) се счита за подобна на паяжина nuyu структура, образувана от цистеинови остатъци в позиции 107, 137, 138, 139 и 149 и локализирани върху външната обвивка на вириона. Пептидните бримки, образувани от аминокиселинни остатъци 107-137 и 139-147, образуват издатини върху вирионната обвивка, а друга стегната бримка се образува от аминокиселинни остатъци 121-124.
Целият BHR е разделен на 5 антигенниобласти, наречени HBsl (от началото до аминокиселинен остатък 120), HBs2 (аминокиселинни остатъци 120-123), HBs3 (a.a. 124-137), HBs4 (a.a. 139-147) и HBs5 (a.a. 148-169). Има доказателства, че пептидните бримки на антигенните региони HBs2 и HBs4 са плътно долепени една до друга.