Окислително печене на хромити за получаване на хромати Физични и химични основи на окислителното печене
Химията на процеса на окислително изпичане на хромит не може да бъде описана с една или повече простиреакции. СместаСъставена от хромит, сода и доломит заедно с газовата фаза, с която взаимодейства, е много сложна многокомпонентна система. При високи температури, в допълнение към газовата и течната фаза, той съдържа голям брой твърди фази, чийто състав зависи от режима на изпичане (стр. 586). Обикновено окислителното калциниране на хромит в присъствието на сода може да бъде представено чрез уравненията на реакцията:
4(?eO • Cr2C0 + 8Na2C03 + 702 = 8Na2Ci 04 + 2Fe203 + 8C02 4(MgO • Cr2O3) + 8Na2C03 + 602 = 8.Va2Cr04 -f 4MgO - f 8C02
В същото време протичат реакции, в резултат на които се появяват много други съединения (виж по-долу), предимно ферити, алуминати, натриеви и калциеви силикати и калциеви хромати.
Железният оксид, който е в заряда в свободно състояние и в състава на хром шпинел, взаимодейства с Na20, CaO, MgO, за да образува ферити и алуминоферити. Също така се образува феррат (1U) натрий
Na20 • Fe203 + 3Na2C03 -f Op02 = 2Na4FtO t + 3C02
Който се разтваря в течната фаза на калцинираната маса и окислява хром (III); това засилва окислителното печене, тъй като, изразходван за окисляването на хромита, като се регенерира многократно, фератът служи като носител на кислород от газовата фаза до повърхността на хромитните зърна 82 > 83.
Окисляването на Cr(III) до Cr(VI) очевидно протича последователно през Cr(IV) и Cr(V). Установено е наличието на натриеви и калциеви хромати (V) в синтора84; те се разтварят в течната фаза на заряда и участват в преноса на кислород - образуват се в резултат на окисляването на хромит (III) с хромат (VI), след което се окисляватгазообразен кислород до хромат (VI).
Образуването на хромат от хромит е ендотермичен процес, изискващ значителни количества топлина. Колкото по-високо е температурното ниво на калциниране на сместа и колкото по-голям е излишъкът от кислород в пещта, толкова по-бързо е окислението.
Взаимодействието на хромит със сода и оксид
Окислителното изпичане се извършва в тръбни ротационни пещи при температури, достигащи 1100-1200 °. Натриевият хромат се появява, когато сместа се нагрява дори при относително ниски температури и образува евтектична стопилка със сода, съдържаща 62,5% Na2Cr04. Появата на течна фаза в системата Na2CrO4-Na2C03 е възможна още при 655°85. При по-нататъшно нагряване на реакционната маса течната фаза се обогатява със сода и съставът на стопилката първо се променя от евтектичната точка по линията ■ "ikvidus. към точката на топене на содата (фиг.170).Но
19 ME Pozin В същото време с нарастваща скорост се образува натриев хромат, който замества содата в течната фаза. Содата се изразходва не само за основната реакция, но и за реакции с други компоненти на заряда - за образуването на ферит, алуминат и натриев силикат (виж по-долу), които след това на свой ред реагират с хромит, вар и кислород, давайки натриев хромат и калциеви инфузионни съединения. До 1000 ° скоростта на образуване на натриев хромат е по-голяма от скоростта на взаимодействие на сода с други оксиди (SiO2, A12O3, Fe2O3) 85. Тъй като содата изчезва от
Течната фаза е разтварянето на нови количества сода. В резултат на тези процеси твърдата сода изчезва много преди сместа да достигне точката на топене на содата. На фиг. 170 схематично показва измерването на състава на течната фаза при повишаване на температурата; изразен е моментът на изчезване на твърда содапрекъсване на кривата в точкаA.
Диаграмата условно не отчита възможността за разтваряне на други компоненти на калцинирания заряд в течната фаза. Следователно на диаграмата течната фаза в края на процеса на калциниране се състои от чист натриев хромат. Всъщност течната фаза съдържа известно количество калциев хромат, който е лесно разтворим в натриев хромат - при 1000 "разтворимостта на калциевия хромат в натриев хромат достига 80%. На практика обаче малко количество калциев хромат се разтваря в стопилката, тъй като разтворените калциеви йони влизат в реакции, водещи до образуването на неразтворим калций um съединения - силикати, ферити, алуминати и др. Само приголямдефицит на сода в сместа може да се появи значително количество калциев хромат в течната фаза.
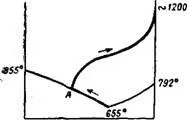
Ориз. 170. Схема за промяна на състава на течната фаза.
На фиг. Фигура 171 показва диаграмата на точката на топене на системата CaClC> 4 + 4-Na2C03 = Na2Cr04 + CaCO3 при ниски температури и в атмосфера на въглероден диоксид, когато калциевият карбонат все още не е разложен86. При тези условия системата е трикомпонентна. (Съставите са дадени в молни проценти.) Следните твърди фази са в равновесие със стопилката:
Технология на минералните соли (торове, пестициди, индустриални соли, оксиди и киселини)
Получаване на хлорен диоксид от натриев хлорит
Когато натриевият хлорит взаимодейства с хлора, се образува натриев хлорид и се отделя хлорен диоксид: 2NaC102 + C12 = 2NaCl + 2 CIO2 Преди това този метод беше основният за получаване на диоксид ...
Схеми с двустепенна амонизация
На фиг. 404 показва диаграма на производството на диамонитро - фоска(тип TVA). Фосфорната киселина с концентрация 40-42,5% P2O5 от колектора 1 се подава от помпа 2 към резервоар под налягане 3, от който непрекъснато се ...
АМОНИЕВ СУЛФАТ
Физични и химични свойства Амониевият сулфат (NH4)2S04 е безцветни ромбични кристали с плътност 1,769 g/cm3. Техническият амониев сулфат има сивкаво-жълтеникав оттенък. При нагряване амониевият сулфат се разлага със загуба на амоняк, превръщайки се в ...