Основни идеи за методите за изчисляване на молекулни орбитали
Химическата връзка, произтичаща от взаимодействието на електрони и ядра, може да бъде описана само математически в рамките на квантовата механика. Това описание е много трудно, тъй като има големи трудности при решаването на съответните уравнения.
Търсенето на приблизителни методи за решаване на такива уравнения за молекулярни системи е един от проблемите на квантовата химия.
Понастоящемдва приблизителни метода за изчисляване на молекули се използват в квантовата химия: методът на валентните връзки и методът на молекулните орбитали.
При метода на валентните връзки се приема, че образуването на молекула става при приближаване на цели атоми, които запазват своята индивидуалност до известна степен в молекулата. В този случай истинското състояние на молекулата се представя като суперпозиция (суперпозиция) на екстремни хомеополярни или йонни структури, които всъщност не съществуват.
При решаването на проблеми по метода на молекулярните орбитали се приема, че по време на образуването на химическа връзка само ядрата първо се приближават едно към друго и едва след това валентните електрони се поставят върху получените многоцентрови молекулярни орбитали и същият подход се използва при изчисляване на молекулярни орбитали, както при изчисляване на атомни орбитали.
Опитайте да помолите учителите за помощ.
При обичайните най-прости изчисления (нулево приближение) се приема, че молекулярната орбитална функция е линейна комбинация от атомните орбитални функции (LCAO приближение).
И двата метода са изключително неточни. Те обаче могат да се използват за оценка на важни количества за химиците: енергия, стабилност на различни форми на молекула, ред на връзката, свободни (неизползвани) индекси на валентност на отделни атоми и разпределение на заряда в молекула.
Всички тези данниполезни при обясняване на характерните особености на реактивността на органичните съединения. Трябва обаче да се има предвид, че характеристиките на стационарното състояние на молекулите в никакъв случай не винаги определят тяхната реактивност: решаваща роля може да играе "благоприятността" или "неблагоприятността" на някои преходни състояния.
С появата на компютрите, първо, простите изчисления бяха значително опростени и, второ, стана възможно да се увеличи приближението.
Резултатите от такива изчисления се използват в някои случаи при последващото представяне на действителния материал.
Задайте въпрос на експерти и получете отговор за 15 минути!
Концепцията за квантово-механични изчисления и реакционни индекси
Преди това беше представено вълновото уравнение на Шрьодингер и информация за неговото приложение за приблизително изчисляване на електронните орбитали ($1s$, $2s$, $2p$) на най-простите атоми. За многоелектронни атоми вълновото уравнение не може да бъде решено точно. Подобни проблеми са още по-сложни в случая на молекулярни орбитали. Въпреки това са разработени изключително опростени приблизителни методи за изчисляване на молекулярни орбитали ($MO$). Сред тези методи за определяне на $MO$ е методът на линейните комбинации от атомни орбитали (LC AO), предложен за първи път от Hund. Методът се основава на предположението, че ако има два електрона в молекулярната орбитала на молекулата $A-B$, всеки електрон, преминавайки близо до ядрото на атома $A$, следва съответната орбитала $A$, по същия начин всеки електрон, намиращ се в сферата на атома $B$, следва орбиталата с функцията $\psi B$ Така функцията на молекулярната орбитала се получава от "линията комбинация от атомни орбитали":
$\psi AB= CA \psi A+ CB \psi B$
където $CA$ и $CB$ са променливи параметри, избрани така, че енергията,изчислен от функцията $\psi AB$ имаше най-малката стойност.
За водородната молекула $H_2$ математическата обработка води до две решения, изразяващи две различни - ниско и високо - енергийни състояния на молекулата. Първата съответства на свързващата молекулярна орбитала, втората на разхлабващата орбитала.
На практика електроните са само в свързващата орбитала.
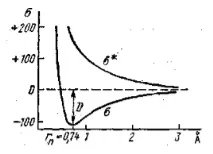
Фигура 1. Криви на потенциалната енергия, свързани с разстоянието между два водородни атома
Друг метод за изчисляване на $MO$ е методът на валентната двойка. И двата метода, подобрени от Hückel, дават близки крайни резултати от изчисленията.
Във всяка наука най-ценните методи и техники са тези, които позволяват не само да се обяснят, но и да се предскажат явления, особено от количествена страна. В това отношение квантовата химия е от особено значение, тъй като в много случаи тя дава възможност да се характеризира количествено реактивността на съединенията. Съединенията с множество връзки, т.е. съдържащите се връзки, имат най-голяма реактивност. При опростени квантово-механични изчисления се оказа възможно, пренебрегвайки взаимодействието на $\sigma $- и $\pi $-електрони, да се характеризира реактивността въз основа на определянето на молекулните орбитали, енергиите и зарядите на атомите въз основа на съответните стойности само за $z$-електрони.
Реакционни индекси
Такива полуемпирични методи позволиха да се изчислят така наречените реакционни индекси, които характеризират електронната структура и дават представа за реактивността на молекулите. Те включват: ред на връзката, индекс на свободната валентност, $\pi $-електронна плътност, енергия на делокализация на електрони и някои други.
1.Ред на връзката ($P$). Тъй катоелектроните са много подвижни, особено в n-орбиталите, не във всички случаи връзките се образуват от двойка електрони или две (три) двойки, т.е. не винаги трябва да се работи с типични единични, двойни и тройни връзки. Това се случва по-специално в диенови системи със спрегнати връзки. В такива системи няма истински двойни и единични връзки. Редът на връзката в такива случаи се изразява в числа, например $1,8942$ за $C(1)-C(2)$ връзката, което показва, че по-малко от две двойки електрони, а именно $1,8942$ от електронна двойка, свързват тези атоми. Останалите електрони се преместват към връзката $C(2)-C(3)$.
Индекс на свободната валентност. Този индекс характеризира мерките за ненаситеност на атом в молекула, неговата способност да се прикрепя.
Електронна плътност. Стойността изразява разпределението на зарядите между атомите на молекулите, което показва кой от атомите най-лесно ще реагира с положително или отрицателно заредени частици (неорганични или отрицателно заредени йони или полярни групи).
Енергия на делокализация (DE). Тъй като един от основните принципи на квантовата механика е принципът на неопределеността, всички електрони не са локализирани в някаква конкретна линейна орбита, те са делокализирани. Делокализацията на електроните стабилизира молекулата. Степента на делокализация обаче варира. Енергията, характеризираща степента на делокализация, се нарича енергия на делокализация; до известна степен характеризира стабилността на молекулата.
Не сте намерили отговора на вашия въпрос?
Просто напишете за какво имате нужда от помощ