Реферат Свойства и структура на водата - Банка с резюмета, есета, доклади, курсови работи и дипломни работи
Държавен университет по архитектура и строителство в Санкт Петербург
Свойства и структура на водата
1. Въведение. Водата в природата 3
2. Структура на водата 5
3. Свойства на водата 11
4. Сребро и стопена вода 20
5. Заключение 22
6. Литература 23
Въведение. Водата в природата.
Най-важното нещо за живота е водата.
Водата е от първостепенно значение в повечето химични реакции, особено биохимичните. Древната позиция на алхимиците - "телата не работят, докато не се разтворят" - до голяма степен е вярна.
Човешкият ембрион съдържа вода,%: тридневен - 97, тримесечен - 91, осеммесечен - 81. При възрастен делът на водата в тялото е 65%.
Човекът и животните могат да синтезират първична („ювенилна“) вода в телата си, да я образуват при изгарянето на хранителни продукти и самите тъкани. При една камила, например, мазнината, съдържаща се в гърбицата, може чрез окисление да даде 40 литра вода.
Връзката между водата и живота е толкова голяма, че дори позволи на В. И. Вернадски „да разглежда живота като специална колоидна водна система. като специално царство на природните води.
Количеството вода, съдържащо се в живите същества, във всеки един момент е огромно количество. Силите на живота преместват десети от процента от целия океан за една година, а за няколкостотин години водни маси преминават през живата материя, надвишавайки масата на Световния океан.
Геохимичният състав на океанската вода е близък до този на кръвта на животни и хора (виж таблицата).
Състав на човешката кръв
Състав на океаните
Водата е много често срещано вещество в природата. 71% от земната повърхност е покрита с вода, образувайки океани, морета, реки и езера. Голяма част от водата е в газообразно състояние като пара в атмосферата; под формата на огромни маси от сняг и лед, той лежи през цялата година по върховете на високите планини и в полярните страни. В недрата на земята също има вода, която напоява почвата и скалите. Общите водни запаси на Земята са 1454,3 милиона км 3 (от които по-малко от 2% е прясна вода, а 0,3% са достъпни за използване).
Природната вода никога не е напълно чиста. Дъждовната вода е най-чиста, но съдържа и малки количества различни примеси, които улавя от въздуха.
Количеството на примесите в прясна вода обикновено е в диапазона от 0,01 до 0,1% (тегл.). Морската вода съдържа 3,5% (тегл.) разтворени вещества, основната маса на които е натриев хлорид (трапезна сол).
Водата, съдържаща значително количество калциеви и магнезиеви соли, се нарича твърда вода, за разлика от меката вода, като дъждовната вода. Твърдата вода произвежда малко пяна със сапуна и образува котлен камък по стените на котлите.
За да се освободи естествената вода от суспендираните в нея частици, тя се филтрира през слой от поресто вещество, като въглища, печена глина и др.
Филтрирането може да премахне само неразтворимите примеси от водата. Разтворените вещества се отстраняват от него чрез дестилация (дестилация) или йонен обмен.
Водата играе много важна роля в живота на растенията, животните и хората. Във всеки организъм водата е средата, в която протичат химичните процеси, осигуряващижизнената дейност на организма; освен това самата тя участва в редица биохимични реакции.
Водата е основен компонент на почти всички технологични процеси, както в промишленото, така и в селскостопанското производство.
Английският физик Хенри Кавендиш открива, че водородът Н и кислородът О образуват вода. През 1785 г. френските химици Лавоазие и Мьоние установяват, че водата се състои от две тегловни части водород и шестнадесет тегловни части кислород.
Не може обаче да се мисли, че това представяне, изразено чрез химическата формула H2O, е, строго погледнато, правилно. Водородните и кислородните атоми, които изграждат естествената вода, или по-точно водородният оксид, могат да имат различно атомно тегло и да се различават значително един от друг по своите физични и химични свойства, въпреки че заемат едно и също място в периодичната таблица на елементите.
Това са така наречените изотопи. Известни са пет различни водорода с атомни тегла 1, 2, 3, 4, 5 и три различни кислорода с атомни тегла 16, 17 и 18. В естествения кислород за 3150 атома от изотопа O 16 има 5 атома от изотопа на кислорода O 17 и 1 атом от изотопа на кислорода O 18. В естествения газообразен водород за 5,5 хиляди атома лек водород Н (протиум) има 1 атом Н2 (деутерий). Що се отнася до H 3 (тритий), както и H 4 и H 5, те са незначителни в естествената вода на Земята, но е много вероятно участието им в космически процеси при ниски температури в междупланетното пространство, в телата на комети и др.
Атомните ядра на изотопите съдържат същия брой протони, но различен брой неутрони. Атомните маси на изотопите са различни.
Единичен електрон се върти около ядрото на водороден атом, така че атомният номер на водорода е едно. Този електрон се върти в кръгови орбити,колективно образуващи сфера. Има много орбити и в зависимост от местоположението на електрона в една или друга кръгова орбита, водородният атом може да има много енергийни състояния на електрона, тоест той може да бъде в спокойно или повече или по-малко възбудено състояние.
Кислородният атом има 8 електрона (атомен номер 8), 6 от които се движат във външни орбити, представляващи формата на осмица или дъмбел, и 2 във вътрешна кръгова орбита. В съответствие с броя на електроните в ядрото на кислородния атом, 8 протона, по този начин самият атом обикновено е неутрален.
Най-стабилната външна орбита на атома е тази, състояща се от 8 електрона, докато кислородът има 6 от тях, т.е. липсват 2 електрона. В същото време водородът, подобно на кислорода, съществува в молекули, съдържащи 2 атома (H2), свързани помежду си с два електрона, които лесно заменят празното място на два електрона от външната орбита на кислородния атом, образувайки заедно водна молекула, с пълна стабилна осемелектронна външна о
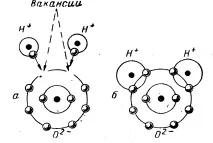
Фигура 1. Схема на образуване на водна молекула (b) от 1 кислороден атом и 2 водородни атома (a).
Могат да се цитират много различни схеми за образуване на водна молекула, базирани на идеите на различни физици. По същество в тях няма противоречия и принципни различия. Всъщност в действителност никой не е виждал структурата на атомите или структурата на молекулата, поради което хипотетичните схеми се изграждат само въз основа на косвени признаци, наблюдавани от устройства, които ни позволяват да приемем както поведението, така и свойствата на атомите и молекулите.
Размерите на атомите на различни елементи варират от около 0,6 до 2,6 A, а дължините на вълните на светлината са няколко хиляди пъти по-големи: (4,5-7,7) * 10 -5 см. Освен това атомите и молекулите нямат ясни граници, поради коетообяснява съществуващото несъответствие между изчислените радиуси.
При нормални условия може да се очаква, че връзките на кислородния атом с двата водородни атома в молекулата на H2O образуват много тъп ъгъл, близък до 180° при централния кислороден атом. Съвсем неочаквано обаче този ъгъл не е равен на 180 , а само 104 31'. В резултат на това вътремолекулните сили не се компенсират напълно и излишъкът им се проявява извън молекулата. На фиг. 2 показва основните размери на водната молекула.
Фигура 2. Водна молекула и нейните размери.
Във водната молекула положителните и отрицателните заряди са разпределени неравномерно, асиметрично. Тази подредба на зарядите създава полярността на молекулата. Въпреки че водната молекула е неутрална, но поради своята полярност тя е ориентирана в пространството, като се вземе предвид привличането на нейния отрицателно зареден полюс към положителен заряд и положително заредения полюс към отрицателен заряд.
Вътре във водната молекула това разделяне на заряда е много голямо в сравнение с разделянето на заряда в други вещества. Това явление се нарича диполен момент. Тези свойства на водните молекули (наричани още диелектрична константа, която е много висока за H2O) са от голямо значение, например, в процесите на разтваряне на различни вещества.
Способността на водата да разтваря твърди вещества се определя от нейната диелектрична проницаемост , която за вода при 0 C е 87,7; при 50 С - 69,9; при 100 C - 55,7. При стайна температура диелектричната константа е 80. Това означава, че два противоположни електрически заряда се привличат взаимно във вода със сила, равна на 1/80 от силата на тяхното взаимодействие във въздуха. По този начин отделянето на йони от кристал на всяка сол във вода е 80 пъти по-лесно, отколкото във въздуха.
Но водата не е самоот същите молекули. Факт е, че една водна молекула може да се дисоциира (раздели) на положително зареден водороден йон H + и отрицателно зареден хидроксилен йон OH -. При нормални условия чистата вода се дисоциира много слабо: само една молекула от 10 милиона водни молекули се разлага на водороден йон и хидроксилен йон. Въпреки това, тъй като температурата се повишава и други условия се променят, дисоциацията може да бъде много по-голяма.
Въпреки че водата като цяло е химически инертна, наличието на H + и OH - йони я прави изключително активна.
Отрицателно заредени кислородни йони (O - ) също могат да бъдат намерени във водата. Освен това в природата могат да се появят и други водородно-кислородни съединения. Тези съединения включват предимно широко разпространения отрицателно зареден хидроксониум H3O +. Среща се в разтвори на халит (NaCl) при високи температури и налягания. Хидроксониумът се намира във възлите на ледената решетка (заедно с други хидроксилни OH - ) в количество (при 0 C) от 0,27 * 10 -9 части, както и в свързано състояние в много минерали.
H3O + и OH - в дълбоките недра са носители на много съединения (особено в процеса на гранитизация). Други съединения на водород с кислород включват водороден прекис (H2O2), перихидроксил (HO2), хидроксил монохидрат (H3O2) и др. Всички те са нестабилни при условията на земната повърхност, но при определени температури и налягания те могат да бъдат в природата дълго време и най-важното - да се превърнат във водна молекула, която ще бъде обсъдена по-долу. H3O2 - намира се в облаците на йоносферата на надморска височина над 100 км.
Както беше отбелязано по-горе, водната молекула обикновено е неутрална. Въпреки това, когато един електрон бъде изтеглен от него чрез бета лъчи (бързи електрони),заредената „молекула“ на водата е положителният йон H2O +. Когато водата взаимодейства с този йон, се появява радикалът ОН - по схемата:
По време на рекомбинацията на хидроксоний H3O + с електрон се освобождава енергия, равна на 196 kcal / mol, достатъчна за разделянето на H2O на H и OH. Свободните радикали играят много важна роля в астрофизиката и във физиката на земната атмосфера. Радикалът ОН е открит на Слънцето и в слънчевите петна в повишено количество. Той също така е открит в звезди и в главата на комети.
Така че, като се има предвид водата само като вещество, състоящо се от атоми, молекули и йони на водород и кислород, и без да се вземат предвид всички други елементи на периодичната система и техните неорганични и органични съединения, които могат да бъдат във вода под формата на разтвори, суспензии, емулсии и примеси, газообразни, течни и твърди състояния, могат да се разграничат 36 съединения - разновидности на водород и кислород, които съставляват водата. В табл. 1 показва девет изотопни разновидности на водата.