Уравнение на Шрьодингер за водородоподобни атоми
Половинчатата полукласическа теория на Бор беше важен етап в развитието на квантовите концепции, чието въвеждане във физиката изискваше радикално преструктуриране на механиката и електродинамиката. Такова преструктуриране е извършено през 20-те - 30-те години на ХХ век.
Моделът на атома на Бор ни позволи да формираме първата (макар и доста груба) идея за структурата на атома. Тя обясни защо атомите излъчват и поглъщат светлина при отделни дължини на вълната и реши проблема с атомната стабилност. Дължините на вълните на линейния спектър и енергиите на йонизация на водородния атом и едноелектронните йони, изчислени в рамките на модела на Бор, се оказаха в отлично съответствие с експеримента. Но теорията на Бор има и значителни ограничения. На негова основа беше невъзможно да се предвидят линейните спектри на по-сложни атоми - дори неутрален атом на хелий само с два електрона. Теорията на Бор не можеше да обясни защо емисионните линии, при по-внимателно разглеждане, се оказаха съставени от две или повече много близки линии (така нареченатафина структура).Теорията на Боран също успя да обясни защо някои спектрални линии са по-ярки от други. Междуатомните връзки в молекулите, твърдите вещества и течностите също не са обяснени. Идеята на Бор за определени орбити, по които се движат електроните в атома, се оказа много условна. Всъщност движението на един електрон в един атом има много малко сходство с движението на планети или сателити. Физическият смисъл е само вероятността да се намери електрон на едно или друго място, описана чрез квадрата на модула на вълновата функцияΨ 2.
Общото уравнение на Шрьодингер:
тукiе имагинерна единица;m- маса на частиците;r -радиус вектор, определящ неговата позиция;∆- операторът на Лаплас, който в правоъгълна декартова координатна система се записва като
За всяко стационарно състояние вълновата функция може да бъде записана като
където функцията зависи само от координатите на частицата;w- реален параметър (честота на вълновата функция).
Стационарно уравнение на Шрьодингер
Вълновата функция, включена в това уравнение, описва състоянието на микрочастица в стационарни състояния.
За да решим вълново уравнение, трябва да разделим неговите променливи. За да направите това, заменете декартовите координатиx, y, zсъс сферичниr, θ, φ.Тогава вълновата функция може да бъде представена като продукт на три функции, всяка от които съдържа само една променлива:
ФункциятаR(r)се нарича радиална компонента на вълновата функция, аΘ(θ) Φ(φ)- нейните ъглови компоненти.
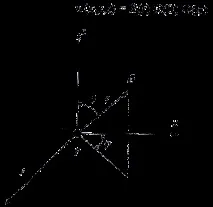
В сферична координатна система уравнението на Шрьодингер се трансформира във вида:
, (1)
къдетоΘиφса съответно полярните и азимуталните ъгли.
При решаването на вълновото уравнение се въвеждат цели числа - така нареченитеквантови числа(главноn, орбиталнои магнитноmℓ).ФункциятаR(r)зависи отnи,функциятаΘ(θ)- от иmℓ,функцияΦ(φ)- отmℓ.
Геометричният образ на едноелектронната вълнова функция еатомната орбитала. Това е област от пространството около ядрото на атом, в която вероятността за намиране на електрон е висока (обикновено изберете стойност на вероятността от 90-95%). Товадумата произлиза от латинското "orbit" (път, следа), но има различно значение, което не съвпада с концепцията за траекторията (пътя) на електрона около атома, предложена от Н. Бор за планетарния модел на атома.Контурите на атомната орбитала са графично представяне на вълновата функция, получена чрез решаване на вълновото уравнение за един електрон.
Квантови числа
Квантовите числа, които възникват при решаването на вълновото уравнение, служат за описание на състоянията на квантовата химическа система. Всяка атомна орбитала се характеризира с набор от три квантови числа: главнатаn,орбитала и магнитнатаmℓ.
Основното квантово числоnопределя квантуването на енергията на атома (виж f.2)
Може да приеме всяка положителна цяло число. Колкото по-голяма е стойността на n, толкова по-висока е енергията и по-голям е размерът на орбиталата.Решаването на уравнението на Шрьодингер за водороден атом дава следния израз за енергията на един електрон:
E \u003d -2π 2 me 4 / n 2 h 2 \u003d -1312,1 / n 2 (kJ / mol)(2)

Така всяка стойност на главното квантово число съответства на определена стойност на енергията на електрона. Енергийните нива с определени стойности на n понякога се означават с буквите K, L, M, N. (за n = 1, 2, 3, 4.).
За E 2 откриване на електрон в различни точки в пространството („електронен облак“).
Състоянията, в които орбиталното квантово число= 0,се описват със сферично симетрични вероятностни разпределения. Те се наричат s-състояния(1s, 2s, .ns, . ).За> 0сферичната симетрия на електронния облак е нарушена.
Състояния с= 1се наричат p-състояния,
с= 2–d-състоянияи др.
На фиг. 1 показва кривите на разпределение на вероятноститеρ (r) = 4πr 2 Ψ 2за откриване на електрон във водороден атом на различни разстояния от ядрото в състоянията1s и 2s.
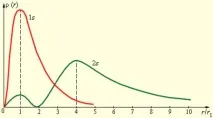
Фигура 1. Разпределение на вероятността за намиране на електрон във водороден атом в състояния 1s и 2s. r1 = 5.29 10 -11 m е радиусът на първата орбита на Бор
Както се вижда от фиг. 1, електрон в състояние1s(основното състояние на водородния атом) може да бъде открит на различни разстояния от ядрото. С най-голяма вероятност той може да бъде открит на разстояние, равно на радиусаr1 на първата орбита на Бор. Вероятността за намиране на електрон в състояние2sе максимална на разстояниеr = 4r1от ядрото. И в двата случая водородният атом може да бъде представен като сферично симетричен електронен облак, в центъра на който е ядрото.
Регионът от пространството, в който има голяма вероятност за намиране на електрон, се нарича подобвивка или орбитала. Изгледът на основните видове орбитали е показан на фиг.2.
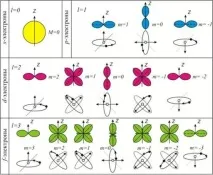
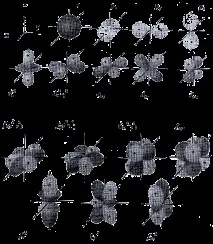
Електронът, заемащ определена орбитала, се характеризира с три квантови числа, описващи тази орбитала. ичетвъртото квантово число (спин) ms,което характеризира спина на електрона - едно от свойствата (наред с масата и заряда) на тази елементарна частица.
ЗАРЪТЯНЕ
През 1925 г. Goudellit и Uhlenbeck предполагат, че друго квантово число s, което трябва да определи разликата между две състояния за едни и същи стойности на n и l, може да бъде свързано с въртенето на електрона около неговата ос. Наистина, ако един електрон се върти около оста си, тогава той трябва да има механичен ъглов моментsи (тъй като имаелектрически заряд) магнитен моментPm.Тозисобствен ъглов момент Ps се нарича спин на електрона.
Точно както орбиталният импулс може да бъде разположен под2l+1различни ъгли спрямо координатната ос, избрана за преобладаващата посока, и неговите проекции върху тази посока могат да бъдат само кратни наћ,спинът на електрона трябва да бъде разположен под 2s+1 ъгли спрямо тази координатна ос (например OZ).
Стойността му е , а проекциите върху тази ос са кратни на ћ,
т.е..
При определяне на ориентацията на спина е логично да се вземе посоката на магнитното поле, образувано поради орбиталното движение на електрона, като преобладаваща посока на координатните оси, тъй като наличието на това поле трябва (дори при липса на външно магнитно поле) да доведе до разделяне наn, lнива, характеризиращи се с тези стойности на квантовите числа, в2s+1поднива.
За да се обясни разделянето на всяко ниво на 2 поднива, очевидно трябва да се запише равенството 2mS+1=2, тоест да се приеме, че спиновото квантово число има полуцяла стойност mS = ½.
Спинът е присъщият магнитен момент на импулса на елементарна частица.Въпреки че тази дума означава "въртене" на английски, спинът не е свързан с никакво движение на частицата, а има квантова природа. Характеризира се спинът на електронаспиново квантово числоms, което може да бъде равно на+1/2 и −1/2.