Урок в 8 клас - Електролитна дисоциация
Раздели: Химия
Образователни: Учениците трябва да повторят известната информация за разтварянето и разтворите; актуализиране на знанията на учениците за различните видове комуникация; дават понятието за: електролити и неелектролити; разгледайте механизма на дисоциация на вещества с различни видове връзки; характеризират общи и единични свойства.
Развитие: Създаване на условия за формиране на способността за анализ на информация, подчертаване на основното, съществено в нея; да продължи развитието на уменията за независимост на умствената работа; сравняват веществата едно с друго.
Образователни: Да продължи работата по формирането на чувство за взаимопомощ и комуникация у учениците в процеса на работа в екип.
методи за организиране на учебни дейности: словесно (диалогично представяне, евристичен разговор, интердисциплинарен разговор, обяснение); визуални (демонстрационен експеримент, демонстрация на символни и графични нагледни средства).
методи за стимулиране на интереса към ученето: образователна дискусия, актуализиране на съществуващите знания и прилагане на придобитите знания на практика.
методи на контрол: устен, предварителен, текущ.
Оборудване за урока:
Организационен момент: маркирайте отсъстващите, обяснете целите на урока
Актуализиране на основните знания по време на фронталното проучване.
1) Какви теории съществуват, за да обяснят процеса на разтваряне?
3) Дефинирайте разтвори въз основа на химическата теория.
4) Какви процеси съвременната наука нарича разтваряне?
Учител: Учипроцесът на разпадане продължи. Шведският химик С. Арениус обърна специално внимание на този въпрос. Той установява, че физическият процес при разтваряне не е дифузия, а дисоциация. С този процес, неговата причина и механизъм ще се запознаем в днешния урок.
План за изучаване на тази тема: (написан на дъската)
1. Електролити и неелектролити.
2. Електролитна дисоциация.
3. Причини за електролитна дисоциация.
4. Механизмът на дисоциация на веществата.
Учител: Учените решиха да разберат дали сложните вещества провеждат ток: оксиди, киселини, соли, основи? Те проведоха цяла поредица от експерименти, които помогнаха да отговорят на този въпрос. Ще изследваме следните вещества: въздух, дестилирана вода, кристална готварска сол, разтвор на готварска сол във вода, разтвор на хлороводород във вода (солна киселина), кристална захар, разтвор на захар във вода. Вашите предположения за тяхната електропроводимост ще бъдат потвърдени или опровергани от горяща или негоряща крушка. Нека направим експеримент:
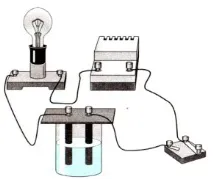
Демонстрационен опит № 1 „Електропроводимост на твърди сухи вещества” (NaCl, KOH, захар). Какъв извод може да се направи?
Демонстрационен експеримент № 2 „електрическа проводимост на разтвори на тези вещества“, електропроводимост на HCl, дестилирана вода.
Въпрос: Разтворите на всички вещества провеждат ли електричество?
Въпрос: На какви групи могат да се разделят разтворите по електропроводимост?
Учител: Веществата по електропроводимост се делят на две групи:
1) Електролитите са вещества, разтвори и стопилки, които провеждат електрически ток (соли, основи, киселини).
2) Неелектролитите са вещества, разтвори и стопилки, които не провеждат електрически ток (дестилирана вода,оксиди, газове, захар и други органични вещества).
Първично обобщение на въвеждането на нови знания в системата от знания на учениците в хода на фронтално проучване:
1) Възможно ли е да се определи по формулите на веществата: CaCO3, O2, NaOH, K2CO3, H2SiO3, CO2, Na2O, H2, Al(OH)3, HNO3, HCl, дали веществото е електролит или не?
2) Кои от веществата, чиито формули виждате, не са неелектролити? Защо?
3) Кои вещества не можем да кажем със сигурност? Защо?
Ученик: За да сте сигурни в определението за електролити и неелектролити, трябва да погледнете таблицата за разтворимост.
4) Кои вещества не са електролити? Защо?
Учител: Въпрос 2. Електролитна дисоциация.
Проблем №1: Защо електролитните разтвори провеждат електричество?
Нека си спомним от курса по физика какво е електрически ток?
Ученик: Електрическият ток е насочено движение на заредени частици.
Учителят: Очевидно, за да може едно вещество да провежда електрически ток, са необходими заредени частици, а те са в солен кристал. В кристала NaCl има заредени частици и експериментът показа, че твърдият NaCl не провежда електрически ток. Защо?
Ученик: Няма движение на заредени частици.
Учителят: Защо разтворът на NaCl провежда електричество?
Ученик: Има движение на заредени частици.
Учител: При разтваряне се отделят заредени частици – йони. S. Arrhenius нарича този процес електролитна дисоциация. (дефиниран)
Учител:Проблем #2:Експериментално е установено, че:
NaCl + H2O - провежда електричество.
NaCl + бензин - не провежда ток.
Защо? Каква е причината?
Студент: Мисля, че разграждането на електролитите в йонипредизвиква разтваряне във вода.
Учителят: Водата е най-удивителното, мистериозно и добре известно вещество:
1) Водата съществува в три агрегатни състояния. За да видите това, просто погледнете през прозореца.
2) Плътността на леда е по-малка от плътността на течната вода, поради което през зимата животът се запазва в резервоари.
3) Водата е универсален разтворител в живата и неживата природа.
Във водната молекула водородните атоми са разположени под ъгъл от 104,5 градуса, поради което молекулата има ъглова форма. Водородните атоми са разположени от едната страна на кислородните атоми. Кислородният атом, като по-електроотрицателен елемент, измества електрон към себе си. В резултат на това се образува отрицателен заряд на кислородния атом и положителен заряд на водородния атом. И така, причината за дисоциацията на водните разтвори е специалната структура на водната молекула.
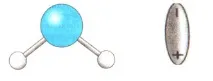
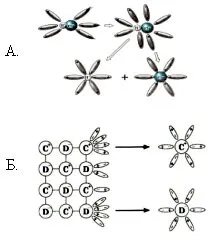
Учител: Помислете как се случва дисоциацията на вещества с йонна връзка (използвайки NaCl като пример).
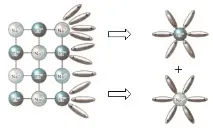
1) Първоначално произволно движещите се водни молекули са разположени в йоните на кристала с противоположно заредени полюси - възниква ориентация.
2) Тогава водните диполи се привличат, взаимодействат с йоните на повърхностния слой на кристала - настъпва хидратация.
3) Молекулите на водата, преминавайки в разтвора, вземат със себе си хидратирани йони - настъпва дисоциация. Опростено, този процес може да бъде отразен с помощта на уравнението: NaCl = Na + + Cl -
Учител: Помислете как протича дисоциацията на вещества с ковалентна полярна връзка (използвайки HCl като пример).
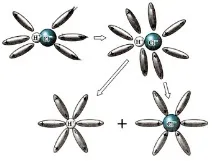
3) Йонизация (т.е. трансформация на ковалентна полярна връзка в йонна).
Опростено, този процес може да бъде отразен с помощта на уравнението: HCl \u003d H + + Cl -
Въпрос: Каква е разликатадисоциация на вещества с йонни и ковалентни полярни връзки? (Учениците сравняват)
Консолидиране на нов материал при изпълнение на задача за корелация: схеми на дисоциация и формули на вещества:
Обобщаване на урока по време на фронталния разговор:
Учител: Днес се запознахме с нови понятия:
1) Електролитна дисоциация.
Разгледахме причините и механизма на дисоциация на вещества с йонни и ковалентни полярни връзки.
Учител: (информира за домашното)
Прочетете параграф № 35, научете дефиниции, отговорете устно на въпроси № 1, 2, 5, 7.