Видео урок „Състав на атомите
На вашия имейл ще бъде изпратен имейл с инструкции за възстановяване на парола
- У дома
- 8 клас
- Химия
- Видео урок „Състав на атомите. Изотопи»



В хода на наблюденията и експериментите се запознахме с много вещества. Научихме, че цялата материя е съставена от атоми, свързани помежду си.
Атомът е най-малката частица от химичен елемент, най-малката част от прости и сложни вещества.
Способността на атомите да образуват различни химични съединения зависи от техния състав и структура. Следователно е необходимо да се изучават атомите, да се познава тяхната вътрешна природа, невидима с просто око, за да се обясни образуването и измененията на веществата. Важна предпоставка за изучаване на състава и структурата на атома беше откриването на явлението радиоактивност.

През 1896 г. френският учен Антоан Анри Бекерел открива, че атомите на химичния елемент уран излъчват α-лъчение, подобно на рентгеновите лъчи. През 1898 г. Мария Склодовска-Кюри получава два нови радиоактивни метала от уранова руда – полоний и радий. Заедно с Пиер Кюри тя установи, че атомите на тези метали излъчват същите лъчи като урана, но по-интензивно. През 1900 г. Пиер Кюри открива γ-лъчение. Уранът, полоният и радият бяха наречени радиоактивни елементи, а самото явление радиация - радиоактивност.
Радиоактивността е свойството на атомите на някои елементи произволно да излъчват частици, невидими за окото, това се дължи на разпадането на техните атомни ядра, превръщането им в други елементи.
Това разпадане е придружено от три вида радиация: α, β и γ.
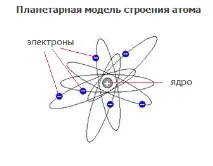
Използвайки α-лъчение (поток от хелиеви ядра с висока скорост, с маса 4 и заряд +2) и тествайки ефекта му върху тънко метално фолио от берилий,Ърнест Ръдърфорд, английски учен, открива, че α-частиците, преминавайки през него, се отклоняват от първоначалната си посока на движение. Това откритие послужи като експериментално доказателство за съществуването на положително заредено атомно ядро.
На негова основа през 1911 г. ученият прогнозира наличието на положително заредена частица, протон, в ядрото на атома и създава планетарен модел на атома.
Според планетарния модел атомът се състои от ядро, което носи положителен заряд и отрицателно заредени частици, електрони, движещи се около него.

През 1932 г. Джеймс Чадуик открива неутрона, а дори по-късно са открити огромен брой различни микрочастици, които изграждат протона.
В съвременната наука протонът, неутронът и електронът са признати за основните елементарни частици на атома. Нека се спрем по-подробно на състава на атома и характеристиките на тези частици.
Атомът се състои от ядро и електрони.Ядрото е част от атома, състояща се от протони и неутрони и имаща положителен заряд. Масата на атома се определя от масата на неговите протони и неутрони.
По своята маса протоните и неутроните са почти еднакви: 1,673 × 10-24 g и 1,675 × 10-24 g. Използването на масата на такива малки частици в грамове е много неудобно, затова се въвежда понятието относителна атомна маса. Сравнявайки масите на протона и неутрона с една въглеродна единица, която е равна на 1,661 × 10-24g, получаваме прости цели числа - масата на протона е 1, масата на неутрона е 1.
Протонът има положителен заряд, равен на +1, а неутронът няма заряд.
Електронът има най-малък заряд (1,6 × 10-19C), който условно се приема за единица,
тези. – 1. Масата на електроните в сравнение с масата на ядрото може да бъде практически пренебрегната (масата на протона е повече от 1800 пъти масата на електрона). Нека обобщимгорното под формата на следните определения.
Протоните са елементарни частици с маса приблизително равна на 1 и заряд +1.
Неутроните са електрически неутрални (незаредени) частици от ядрото на атом с маса, равна на 1.
Електроните са отрицателно заредени частици на атом, разположени около ядрото на атома. Те образуват електронната обвивка на атома.
Разновидности на атомни ядра с определен брой протони и неутрони се наричат нуклиди.
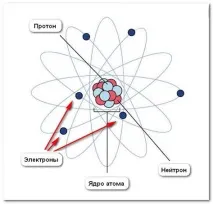
Според съвременната ядрена теория протоните и неутроните, които изграждат ядрото, са свързани заедно от изключително големи ядрени сили. Ядрото е много компактно по размер. Той е 100 000 пъти по-малък от самия атом, но има висока плътност. Той съдържа почти цялата маса на атома.
Частиците, които изграждат един атом, определят най-важните му характеристики. Вече сме запознати с някои от тях (валентност, маса и други).
Зарядът на ядрото е най-важната характеристика на атома и съответния му химичен елемент, която е в основата на съвременното му определение. Положителният заряд на ядрото се създава от неговите протони: зарядът на ядрото е равен на броя на протоните в него. Поредният (атомен) номер на елемент в периодичната система е равен на заряда на ядрото на неговите атоми и се обозначава с буквата Z. Следователно ядреният заряд е и най-важната характеристика на химичния елемент.
Елементът е вид атом с еднакъв ядрен заряд.
Друга характеристика на атома, зависима от протоните и неутроните на ядрото, е масата на ядрото. Означава се с буквата А и се нарича масово число.
Масовото число е сумата от броя на протоните и неутроните в ядрото на атома.
И двете характеристики се използват за индексиране на атома: те се поставят отляво на символа на елемента, където A е горният индекс, а Z е долният индексиндекс, например: 126С.
Протоните и неутроните определят количествените характеристики на атомите. Неговите качествени характеристики зависят от електроните на атома - способността да се комбинира с други атоми, химичните свойства.
Нека се обърнем към периодичната система от химични елементи на Д. И. Менделеев.
Виждаме, че числата, изразяващи атомните маси на елементите, имат дробни стойности и при редовно линейно увеличение на атомните маси на химичните елементи има известно „нарушение“ на модела.
Възниква въпросът защо при двойки елементи аргон - калий, кобалт - никел, телур - йод, водещият елемент има по-голяма атомна маса от следващия, защо атомните маси на елементите са обозначени с дробни числа, ако масите на протоните и неутроните се приемат за 1, а масата на електроните като незначителна може да се пренебрегне? Каква е причината за явните "нарушения"?
Отговорите се дават чрез експериментални и теоретични изследвания на състава на ядрата и масите на атомите с различни методи. Те показаха, че ядрата на атомите на един и същи елемент винаги съдържат един и същ брой протони, но могат да съдържат различен брой неутрони. Такива атоми се различават един от друг по различни масови числа и някои свойства (например различни скорости на дифузия). Така например елементът въглерод съдържа атоми с брой неутрони 6, 7, 8. Но всички те принадлежат към един и същ елемент - въглерод, тъй като зарядът на ядрото е еднакъв за тях: +6.
Разновидности на атоми на един и същи елемент, които имат еднакъв ядрен заряд, но различни атомни маси, се наричат изотопи.
Терминът идва от гръцкия isos - "равен", topos - "място", тоест заемащ едно и също място в периодичната система.

Относителната атомна маса на химичен елемент е равна на среднатастойността на масите на всички негови естествени изотопи, като се вземе предвид тяхното изобилие. Като стандарт за определяне на относителната атомна маса се приема 1/12 от масата на въглеродния изотоп 12C.
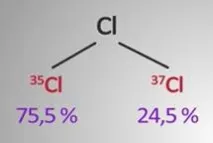
Относителната атомна маса на хлора е 35 x 0,755 + 37 x 0,245 = 35,459 = 35,5.
Виждаме същата стойност в периодичната таблица.
Феноменът на изотопията позволява да се обясни причината за някои "нарушения" при последователното увеличаване на стойностите на атомните маси на елементите в споменатите по-горе двойки: аргон - калий, кобалт - никел, телур - йод.
Изотопите са известни на всички химични елементи. Елементите с атомен номер 2 имат най-голям брой изотопи, от 40 до 56.
Теорията за структурата на ядрото и явлението изотопия позволяват да се изясни концепцията за относителната атомна маса на елемента, да се задълбочат знанията за елемента и да му се дадат по-съвременни определения. Елементът е вид атом с еднакъв ядрен заряд. Химическият елемент е сбор от неговите изотопи.