Водата и нейните съвременни модели, физични и химични свойства на водата
 |
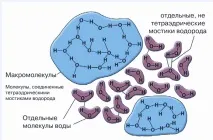
Характеристиките на физичните свойства на водата и множеството краткотрайни водородни връзки между съседните водородни и кислородни атоми във водната молекула създават благоприятни възможности за образуване на специални асоциирани структури (клъстери), които възприемат, съхраняват и предават голямо разнообразие от информация.
Един от първите модели на водата е моделът на Франк и Уен [Frank & Уен, 1957]. В съответствие с него водородните връзки в течната вода непрекъснато се образуват и разрушават и тези процеси протичат кооперативно в рамките на краткотрайни групи от водни молекули, наречени „блестящи клъстери“. Продължителността на живота им се оценява в диапазона от 10–10 до 10–11 s. Това представяне правдоподобно обяснява високата степен на подвижност на течната вода и нейния нисък вискозитет. Смята се, че поради тези свойства водата е един от най-универсалните разтворители.
 |
Моделът на „мигащите клъстери“ обаче не може да обясни много факти, които отдавна са известни, както и тези, които са започнали да нарастват бързо в последно време.
Но през втората половина на 20 век възникват две групи „смесени“ модели: клъстерни и клатратни. В първата група водата се появява като клъстери от молекули, свързани с водородни връзки, които се носят в море от молекули, които не участват в такива връзки. Моделите от втората група разглеждат водата като непрекъсната мрежа (обикновено наричана рамка в този контекст) от водородни връзки, която съдържа празнини; те съдържат молекули, които не образуват връзки с молекулите на рамката. Не беше трудно да се изберат такива свойства и концентрации на две микрофази на клъстерните модели или свойствата на рамката и степента на запълване на нейните празнини в клатратните модели, за да се обяснят всички свойства на водата, включително известните аномалии.
Моделът тип клатрат е предложен от O.Ya. Самойлов през 1946 г.: във водата се запазва мрежа от водородни връзки, подобна на шестоъгълен лед, чиито кухини са частично запълнени с мономерни молекули. L. Pauling през 1959 г. създава друга версия, предполагайки, че мрежата от връзки, присъщи на някои кристални хидрати, може да служи като основа за структурата.
През втората половина на 60-те и началото на 70-те години се наблюдава сближаване на всички тези възгледи. Появяват се варианти на клъстерни модели, при които молекулите в двете микрофази са свързани с водородни връзки. Поддръжниците на клатратните модели започнаха да позволяват образуването на водородни връзки между празните и рамковите молекули.
През 1990 г. чл.-кор. Академия на науките на СССР G.A. Домрачев (Институт по органометална химия RAS) и физикът D.A. Селивановски (Институт по приложна физика, Руската академия на науките) формулира хипотеза за съществуването на механохимични реакции на радикална дисоциация на водата [Домрачев, 1995]. Те изхождат от факта, че течната вода е динамично нестабилна полимерна система и че, по аналогия с механохимичните реакции в полимерите при механично въздействие върху водата, енергията, абсорбирана от водата, която е необходима за разрушаване на H-OH, е локализирана в микромащабната област на структурата на течната вода. Реакцията на разкъсване на H-OH връзката може да бъде записана по следния начин: (Н2О)n(Н2О. H--OH) (Н2О)m + E (Н2О)n+1(H) + (OH) (Н2О)m, където "E" означава несдвоен електрон.
Тъй като дисоциацията на водните молекули и реакциите, включващи Н и ОН радикали, се случват в свързаното състояние на течна вода, радикалите могат да имат огромен (десетки секунди или повече) живот преди смъртта си в резултат на реакции на рекомбинация [Blough et al., 1990].
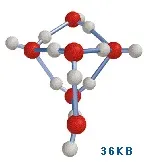
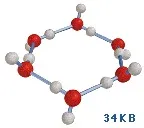
По този начин има доста убедителни доказателства, че течната вода съдържа многостабилни полимерни структури. През 1993 г. американският химик Кен Джордан предлага свои собствени версии на стабилни „водни кванти“, които се състоят от 6 нейни молекули [Tsai & Йордания, 1993]. Тези клъстери могат да се комбинират помежду си и със „свободни“ водни молекули поради водородни връзки, изложени на тяхната повърхност. Интересна особеност на този модел е, че автоматично следва, че свободно растящите водни кристали, познати ни като снежинки, трябва да имат 6-лъчева симетрия.
 |  |
През 2002 г. групата на д-р Хед-Гордън, използвайки рентгенов дифракционен анализ с помощта на Advanced Light Source (ALS), успя да покаже, че водните молекули са способни да образуват структури, дължащи се на водородни връзки - "истинските тухли" на водата, които са топологични вериги и пръстени от много молекули.
Друга изследователска група на Нилсон от Синхротронната лаборатория на същия Станфордски университет, интерпретирайки получените експериментални данни като наличие на структурни вериги и пръстени, ги счита за доста дълготрайни структурни елементи.
Въпреки факта, че различните модели предлагат клъстери с различна геометрия, всички те постулират, че водните молекули могат да се комбинират, за да образуват полимери. Но класическият полимер е молекула, всички атоми на която са обединени от ковалентни връзки, а не от водородни връзки, които доскоро се считаха за чисто електростатични. Въпреки това през 1999 г. беше експериментално показано, че водородната връзка между водните молекули в леда е частично (10%) ковалентна [Isaacs E.D., et al., 1999]. Дори частично ковалентният характер на водородната връзка „позволява“, спореднай-малко 10% от водните молекули се комбинират в достатъчно дълготрайни полимери (без значение каква е специфичната структура). И ако във водата има водни полимери, тогава дори леките ефекти върху абсолютно чиста вода и още повече върху нейните разтвори могат да имат важни последствия.
Моделът на структурираната вода определя почти всички нейни аномални свойства, които са от голямо практическо значение - водата е най-аномалното от всички известни на природата вещества. Диаметърът на водната молекула е 2,8 A (1 ангстрьом = 10-10 m). Ако разглеждаме водата като прост набор от молекули H2O, тогава се оказва, че нейното специфично тегло трябва да бъде 1,84 g/cm3, а точката на кипене ще бъде 63,5 ° C. Но, както знаете, при нормална температура и налягане специфичното тегло на водата е 1 g/cm3, а водата кипи при 100°C. Въз основа на това трябва да се приеме, че вътре във водата трябва да има празнини, където няма молекули H2O, тоест специална структура е присъща на водата. Това фундаментално откритие е направено от английския физик Бернал. Оттогава са проведени много изследвания в тази област, но все още няма пълна яснота по този въпрос.