Значение на апоптозата в развитието на вирусни инфекции и рак
• Вирусните инфекции и ракът са патологични състояния, при които апоптозата може да бъде блокирана
Вируситеса задължителни вътреклетъчни паразити и следователно смъртта на клетката гостоприемник е една от формите за борба с вирусните инфекции. Следователно поддържането на жизнеспособността на клетките е в интерес на вируса. Много вируси правят това, като блокират клетъчната смърт и механизмите на това блокиране играят важна роля в разбирането на етапите на апоптозата.
Както беше отбелязано, при насекомите апоптозата се регулира на нивото наактивиране на каспаза IAP. Бакуловирусите на насекомите блокират апоптозата по абсолютно същия начин чрез експресиране на IAP, който инхибира DRONC и ефекторните каспази. Тези вируси обаче експресират и друг протеин, р35, който свързва и инхибира активните каспази. Чрез блокиране на активирането на каспаза, тези вируси поддържат жизнеспособността на клетките, докато се произведат достатъчен брой вирусни частици и настъпи клетъчен лизис.
Гръбначнитевирусиследват различна стратегия, вероятно защото каспазното инхибиране не блокира увеличаването на MOMP или каспаза-независимата смърт (и може да стимулира имунен отговор към присъствието на вируса). Следователно, някои гръбначни вируси произвеждат антиапоптотични протеини, принадлежащи към семейството Bcl-2, като E1B19K и BHRF протеина на вируса на Epstein-Barr. Тези и други вирусни Bcl-2 протеини функционират като Bcl-2 за предотвратяване на повишаване на MOMP и апоптоза.
Вируситена гръбначните животни често функционират чрез предотвратяване на апоптоза, предизвикана от ефекторни клетки на имунната система. Например вирусът варицела-зостер произвежда протеазни инхибитори, наречени серпини, които могат да блокират гранзим В и каспаза-8 (но не и каспаза-9).или ефекторни каспази). Като блокира гранзим В, вирусът избягва ефекта на цитотоксичните лимфоцити, които търсят в тялото заразени клетки.
По подобен начин,инхибирането на каспаза-8води до блокиране на апоптозата, индуцирана от лигандно свързване към рецептори на клетъчна смърт; тези лиганди често се произвеждат от цитотоксични лимфоцити и други клетки в отговор на вирусна инфекция. Друг начин, по който вирусите блокират апоптозата, включваща рецептори за клетъчна смърт, е чрез експресията на молекули, близки до c-FLIP, като протеина v-FLIP, произведен от херпесния вирус.
Други патологични състояния, свързани с нарушения наапоптозните механизмиса неопластични заболявания. Както беше отбелязано в началото на този раздел, мощният туморен супресорен протеин р53, който е мутиран в приблизително 30% от човешките ракови заболявания, упражнява своя супресорен ефект отчасти чрез индуциране на апоптоза в трансформирани клетки.
По подобен начин, антиапоптотичниятпротеин Bcl-2е открит за първи път при изследване на хромозомнитранслокация, възникваща при фоликуларен В-клетъчен лимфом. При рака има промени в механизмите за контрол на апоптозата.
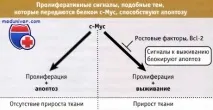
Въпреки това, връзката междуапоптозатаи рака е по-фундаментална, отколкото илюстрират тези прости примери. Клетките на гръбначните стават чувствителни към задействане на апоптоза чрез сигнали, които обуславят влизането им в цикъла, и решението да живеят или да умрат се основава на сигнали, предавани на клетката от околните тъкани (напр. като растежни фактори). При липса на тези фактори в клетките в цикъла настъпва апоптоза и това ограничава растежа на тъканите. Фигурата по-долу, например, показва, че c-Myc насърчава не само клетъчната пролиферация, но и клетъчната апоптоза.
Следователно, експресията на този протеин в тъканта, в отсъствието на другисигнали, не насърчава непременно клетъчна експанзия (или туморен растеж). Основната връзка между клетъчния цикъл и апоптозата вероятно ще бъде фундаментална за изясняването на въпроса дали ние, като дългоживеещ многоклетъчен организъм, можем да съществуваме без развитие на рак. Клетъчният цикъл не е причина за апоптозата; същите молекули, които осигуряват навлизането на клетката в цикъла, също предизвикват апоптоза, която се потиска от антиапоптотични сигнали.
Въпреки че c-Myc насърчава пролиферацията и апоптозата,Bcl-2илиBcl-xLмогат да функционират във връзка с c-Myc и да започнат процеса на онкогенеза чрез блокиране на апоптозата. Наистина, активирането на антиапоптозни протеини от семейството Bcl-2 често се наблюдава при хора с рак. Такава кооперативна връзка между двата типа онкогени при рак (проапоптотичен и пролиферативен, плюс антиапоптотичен) вероятно представлява общ принцип.Като цяло може да се каже, че онкогените могат да бъдат подобни на c-Myc (насърчаващи както пролиферацията, така и апоптозата), Bcl-2 (блокиращи апоптозата, без да засягат пролиферацията) или подобни на двете (насърчаващи пролиферацията и блокиращи апоптозата поради множество сигнали).
Распротеинът в неговата активна форма може да участва в различни сигнални пътища, които водят до тези два резултата. По този начин, в зависимост от условията, Ras може или да стимулира, или да инхибира апоптозата.