1.3.2. Галванопластика
Един от начините за защита срещу корозия е нанасянето на повърхностни галванични покрития. Електроотлагането има редица предимства пред другите методи за защита, тъй като Позволява:
• регулиране на дебелината на слоя;
• икономично използване на цветни метали;
• за нанасяне на покрития от метали с висока точка на топене, като хром, никел, мед, сребро, платина.
Защитните електрохимични покрития трябва да имат:
• възможност за изолиране на продукта от агресивната среда;
• собствена устойчивост на корозия;
• дадени физични и механични свойства.
Видът на покритието, неговата дебелина и предназначение се регулират от GOST 9.303-84 и GOST 9.306-85.
Защитните антикорозионни покрития могат да бъдат анодни и катодни.
Металните покрития трябва да са непроницаеми за корозивни агенти. Въпреки това, ако в металното покритие има дефекти под формата на пори, драскотини, вдлъбнатини, тогава естеството на корозионното увреждане на основния метал се определя от електрохимичните характеристики на двата метала. По отношение на стоманата, цинковото покритие е анодно, а медното е катодно.
Следователно цинкът започва да се разгражда първоначално. В същото време той предпазва желязото или стоманата от разрушаване толкова по-дълго, колкото по-голяма е дебелината на покритието, т.е. е протектор (фиг. 4, а). Медта е катодно покритие по отношение на желязото, т.к има по-положителен потенциал. Следователно желязото ще бъде подложено на разрушаване и в по-голяма степен, колкото по-висока е порьозността на медното покритие (фиг. 4, б).
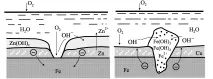
Фиг.4. Схема, обясняваща ефекта на анодното (а) и катодното (б) по отношение на основния метал на металните покрития
1.3.3. Поцинковане и кадмиране
Цинковите покрития се използват за защита срещукорозия на машинни части, тръбопроводи, стоманени листове. Цинкът е евтин и лесно достъпен метал. Той защитава основния продукт механично и електрохимично, тъй като при наличие на пори или оголени петна цинкът се разрушава и стоманената основа не корозира.
Доминират цинковите покрития. С помощта на цинк приблизително 20% от всички стоманени части са защитени от корозия, а около 50% от цинка, произведен в света, се изразходва за галванични покрития.
Цинкът намери широко приложение като защитно покритие за продукти от желязо и стомана. Цинкът е топим (Tmelt = 419 ° C), мек и нискоякостен метал. ПДК във вода е 0,01 mg/l. Стандартният електроден потенциал на цинк Zn 2+ + 2e \u003d Zn е -0,76 V.
В 3% разтвор на NaCl електродният потенциал на цинка е -0,83 V.
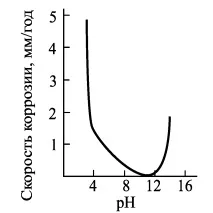
Фиг.5 Влияние на pH върху кор.6.
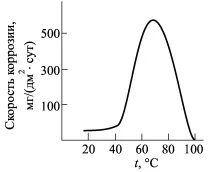
росия Зн. Температурен ефект
върху скоростта на корозия на Zn в
Цинкът има максимална стабилност в диапазона на pH между 9 и 11 (фиг. 5). Използването на цинкови покрития е нерационално, ако pH на средата е значително по-малко от 7 или повече от 12 поради повишена корозия на цинка.
Цинкът е стабилен във вода до 55°C (фиг. 6). Скоростта на корозия рязко нараства с повишаване на температурата и достига максимум при 70 °C, след което намалява. Наблюдаваните закономерности са свързани с факта, че при температури до 50 °C и над 95 °C върху цинка се образува плътен филм с високи защитни свойства. В температурния диапазон (55-65) °C се наблюдава образуване на свободни продукти от корозия с ниски защитни свойства. При 100°C продуктите на корозията се уплътняват и също така има намаляване на разтворимостта на кислорода в корозивната среда.
В чиста и морска атмосфера цинкът е устойчив, тъй като е покрит със слой от корозионни продукти от хидроксиди.и основни цинкови карбонати. В среди, замърсени с SO2, SO3, HC1 в индустриални зони, стабилността на цинка и цинковите покрития е значително намалена.
Цинкът се използва за защита на стоманата от атмосферна корозия. Използва се за получаване на медни, никелови, магнезиеви сплави, при производството на батерии и като протектор при електрохимичната защита на железни сплави.
Кадмият е сребристобял, мек метал. Плътността е 8,65. Стандартният електроден потенциал на кадмий Cd 2+ + 2e \u003d Cd е -0,40 V, а стационарният потенциал е 0,5 n. Разтвор на NaCl -0,52 V. MPC във вода е 0,005 mg / l.
Кадмият е ковък и ковък метал, който може лесно да се навива на листове и да се изтегля в тел.
Способността за пасивиране на кадмий е ниска. Следователно при контакт с желязото, което има склонност към пасивиране, в повечето случаи кадмият е анод. Кадмият се използва главно за анодизиране на стомана и алуминиеви сплави.
Кадмият е подобен на корозионното поведение на цинка. В неутрални разтвори кадмият корозира с кислородна деполяризация. За разлика от цинка, скоростта на корозия на кадмия намалява с повишаване на pH.
Поради по-малко отрицателния потенциал на електрода, кадмият е по-стабилен в кисели и неутрални разтвори от цинка. В основи е доста стабилен. Кадмият е устойчив на морска вода и морска атмосфера. Наличието на SO2 и SO3 в газовете води до бързо разрушаване на кадмия. Кадмият се използва за производство на сплави с мед. Високата токсичност на кадмия ограничава използването му като защитно средство
Кадмият има по-близък потенциал до желязото, отколкото цинка. Естеството на кадмиевата защита зависи от корозивната среда. Във влажна атмосфера и в присъствието на хлоридни йони потенциалът на кадмийстава по-електроотрицателен от потенциала на желязото и кадмият електрохимично предпазва метала от корозия.
За поцинковане и кадмиране се предлагат електролити, в които металите са под формата на прости соли или под формата на сложни съединения. Най-голямо приложение са получили сулфатните електролити. Техният състав (g/l):

Катодната плътност на тока при поцинковане е 100-400 A/m 2 , при кадмиево покритие - 80-120 A/m 2 . Температурата на електролита и за двата процеса е 15-30°C.