15. Класификация на комплексни съединения.
Класификацията на комплексните съединения се извършва по различни критерии.
Според заряда на комплексния йон се разграничават:
Според природата на лигандите се разграничават:
Според структурата на вътрешната сфера се разграничават вътрешнокомплексни (циклични) съединения. Например подобни на нокти (хелати) петчленни цикли се намират в жив организъм. Образувани са от метален катион и α-аминокиселини. Те включват хемоглобин, хлорофил, витамин В12.
Класификацията на комплексните съединения според естеството на координираните лиганди в момента е най-често срещаната. Тази класификация обаче е напълно приложима само за онези комплексни съединения, чиято вътрешна сфера се състои от идентични лиганди. Въпреки това, той позволява да се комбинират комплексите в определени групи според общността на методите на синтез и определени физикохимични свойства.
Аквакомплексите са йони или молекули, в които водните молекули служат като лиганди. Във водни разтвори на соли почти всички йони съществуват като аква йони, например [Be(H2O)4]2+, [Al(H2O)6]3+, [Cr(H2O)6]3+. По време на кристализацията на такива соли от водни разтвори водата остава свързана с комплексообразователя: [Be(H2O)4]SO4, [Al(H2O)6](SO4)2, [Cr(H2O)6]Cl3.
Аквакомплексите включват много кристални хидрати, например [Al(H2O)6]Cl3 (иначе AlCl3.6H2O), [Cr(H2O)6](NO3)3 (иначе Cr(NO3)3.6H2O). В някои кристални хидрати някои от водните молекули навлизат във вътрешната сфера, докато останалите са във външната сфера и се свързват с йоните на външната сфера. Например, меден(II) сулфат пентахидрат - [Cu(H2O)4]SO4.H2O и никелов(II) сулфат хептахидрат - [Ni(H2O)6]SO4. H2O съдържа аквакомплекси - тетрааквамеден(II) катион и хексаакваникелов(II) катион и слабо свързана външна сферична водна молекула, която обединявакатиони и аниони чрез водородни връзки.
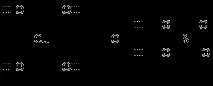
[Zn(H2O)4]2+ + H2O [Zn(H2O)3(OH)]+ + H3O+
Киселинните свойства на аквакомплексите са толкова по-изразени, колкото по-висока е степента на окисление на комплексообразуващия атом.
Хидроксо комплексите са комплексни съединения, съдържащи хидроксидни йони OH-- като лиганди. Хидроксо комплексите се образуват в реакции на хидролиза от аква комплекси:
[Al(H2O)6]3++ H2O [Al(H2O)5(OH)]2+ + H3O+
или при разтваряне на амфотерни хидроксиди във водни разтвори на хидроксиди на алкални метали:
Zn(OH)2 + 2OH-- = [Zn(OH)4]2--
Водните разтвори на хидроксо комплексите имат алкална реакция:
[Zn(OH)4]2-- + H2O [Zn(H2O)(OH)3]-- + OH--
Хидроксокомплексите са стабилни само в силно алкални разтвори. В неутрална и още повече в кисела среда, както и при нагряване на разтворите, те се разрушават:
[Al(OH)4]-- + CO2 = Al(OH)3↓ + HCO3--
[Be(OH)4]2-- + 2NH4+ = Be(OH)2↓ + 2NH3. H2O
[Zn(OH)4]2-- + 4H3O+ = [Zn(H2O)4]2+ + 4H2O
Амоняците са сложни съединения, в които функциите на лиганди се изпълняват от молекули NH3. По-точно име за комплекси, съдържащи амоняк във вътрешната сфера, е аминокомплекси; обаче, молекулите на NH3 могат да бъдат разположени не само във вътрешната, но и във външната сфера на съединението - амоняк. Амонячните комплекси обикновено се получават чрез взаимодействие на метални соли или хидроксиди с амоняк във водни или неводни разтвори или чрез третиране на същите соли в кристално състояние с газообразен NH3:
AgCl(t) + 2NH3. H2O = [Ag(NH3)2]Cl + 2H2O
CoCl2 + 6NH3(g) = [Co(NH3)6]Cl2
Образуването на аминокомплекси във водни разтвори става чрез последователно заместване на водните молекули във вътрешната сфера на аквакомплексите с амонячни молекули:
[Cu(H2O)4]2+ + NH3. H2O [Cu(H2O)3(NH3)]2+ + 2H2O;
[Cu(H2O)3(NH3)]2+ + NH3. H2O [Cu(H2O)2(NH3)2]2+ + 2H2O и др.
Амоняците се разрушават от всякакви влияния, които премахват (при нагряване) или разрушават (чрез действието на окислител) молекула на амоняка, превръщат амоняка в кисела среда в амониев катион или свързват централния атом на комплекса, например под формата на слабо разтворима утайка:
[Ni(NH3)6]Cl2 = NiCl2 + 6NH3(g)
[Cu(NH3)4]SO4 + 6Br2 = CuSO4 + 12HBr + 2N2(g)
[Ni(NH3)6]SO4 + 3H2SO4 = NiSO4 + 3(NH4)2SO4
[Cu(NH3)4](OH)2 + Na2S + 4H2O = CuS↓ + 2NaOH + 4NH3.H2O
Киселинни комплекси. В киселинните комплекси лигандите са аниони на киселини, органични и неорганични: F-, Cl-, Br-, I-, CN-, NO2-, SO42-, C2O42-, CH3COO- и др. Тази група комплексни съединения може да бъде разделена на две части: комплекси с кислородсъдържащи лиганди и комплекси с безкислородни (главно халидни или псевдохалидни) лиганди.
Например киселинните комплекси с кислородсъдържащи лиганди включват дитиосулфатния аргентатен (I) йон, който се получава чрез обменна реакция:
Ag+ + 2 SO3S2 = [Ag(SO3S)2]3
и хексанитрокобалтатен (III) йон, който се утаява като малки жълти кристали на калиева сол при смесване на разтвори, съдържащи кобалтов (II) хлорид, калиев нитрит и оцетна киселина:
CoCl2+7KNO2+2CH3COOH=K3[Co(NO2)6] + NO + 2 KCl + 2 CH3COOK + H2O
При тази редокс реакция степента на окисление на кобалта се променя от +II на +III. Реакцията се използва заопределяне на калиеви примеси в натриеви соли.
Примери за киселинни комплекси с безкислородни лиганди са калиев хексахлороплатинат(IV) K2[PtCl6] и калиев хексацианоферат(II) K4[Fe(CN)6]. Платината се разтваря химически в смес от концентрирана азотна и солна киселина („царска водка“), за да образува водороден хексахлороплатинат (IV) H2[PtCl6]:
3 Pt + 4 HNO3 + 18 HCl = 3 H2[PtCl6] + 4 NO + 8 H2O
Водородният хексахлороплатинат (IV) е първият реагент, който постави началото на аналитичната химия на калий, рубидий и цезий, тъй като хексахлороплатинатите (IV) на тези елементи K2[PtCl6], Rb2[PtCl6] и Cs2[PtCl6] са умерено разтворими във вода.
Калиев хексацианоферат (II) се образува при реакцията:
6 KCN + FeSO4 = K4[Fe(CN)6] + K2SO4
От воден разтвор се изолира калиев хексацианоферат(II) под формата на жълти кристали със състав K4[Fe(CN)6]. 3H2O. Това съединение се използва широко в аналитичната практика за определяне на наличието на железни (III) катиони в пробите:
[Fe(H2O)6]3+ + K+ + [Fe(CN)6]4= KFe[Fe(CN)6] + 6 H2O
Продуктът от тази реакция е слабо разтворим желязо(III)-калиев хексацианоферат(II) KFe[Fe(CN)6] с ярко син цвят.
За разрушаване на киселинни комплекси могат да се използват реакции на обмен на лиганди, които в случай на образуване на по-стабилни комплекси преминават почти до края. Например, въвеждането на флуорид-съдържащ реагент в яркочервен разтвор на железен (III) тиоцианатен комплекс със състав [Fe(NCS)6]3- го обезцветява:
[Fe(NCS)6]3+ 4 F + 2 H2O = [Fe(H2O)2F4] + 6 NCS
Друг начин за разрушаване на киселинния комплекс е свързването на комплексообразователя под формата на трудноразтворима утайка. Така тетрайодомеркурат(II)-йон [HgI4]2 се разрушава под действието на сулфидни йони S2:
[HgI4]2 + S2 = HgS +4 I-; PR (HgS) \u003d 1.4. 10-45
Анионните халогени са комплексни съединения, в които и комплексообразувателят, и лигандите са халогени. Това са комплекси със състав M[EG'xG"y], където M е голям катион с нисък заряд, например катион на алкален метал или амониев катион; E-халогенен комплексообразуващ агент, атом или молекула, обикновено с ниска електроотрицателност (йод, бром, по-рядко хлор); G' и G" са халогенни йони. Степента на окисление на комплексообразуващия агент Е в анионни халогенати може да бъде положителна, например I3+ в K[ICl4], нула, както в Na2[(I2)(I3)2]-, и отрицателна в K[I(I2)2].
Анионните халогени се получават чрез взаимодействие в разтвор на халогенни соли с халогени или интерхалогенни съединения:
KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(BrCl)]; 2RbCl + I2Cl6 = 2Rb[ICl4]
Анионните халогени, когато се нагряват, лесно се разлагат с освобождаване на свободни халогени или интерхалогенни съединения и халогенни соли, а солта винаги съдържа най-електроотрицателния от халогените:
Rb[IBr2](t) = RbBr(t) + IBr(g);
K[I(I)2](t) = KI(t) + I2(t)
Катионните халогени са съединения, съдържащи катиони, в които както комплексообразователят, така и лигандите са халогени. Катионните халогени имат състав [EG'xG"y]Z, където E е халогенен комплексообразуващ агент; G' и G" са халидни лиганди; Z е анион като [SbF6]-, [SbCl6]-, [AsF6]-, [BF4]- и др. Например: [ICl4][SbCl6].
Всички катионни халогени са силни окислители. Те реагират бурно с вода и органични разтворители.
Хидридни комплекси съдържат лигандния хидриден йон Н- като лиганден хидриден йон. Комплексообразователи в хидридните комплекси най-често са елементи от група IIIA - бор,
алуминий, галий, индий, талий. Хидридните комплекси са най-силните редуциращи агенти. Под действието на киселини ивъв водната среда те се разлагат, освобождавайки водород:
Na[AlH4] + 4H2O = NaOH + Al(OH)3 + 4H2↑
Карбонилни комплекси - комплексни съединения, в които лигандът е карбонил - въглероден оксид (II) - CO. Степента на окисление на метала в сложните карбонили обикновено е нула. Например: [Cr(CO)6] , [Mn2(CO)10]. Карбонилните комплекси при нормални условия са кристални вещества или течности, силно летливи и с ниски точки на топене и кипене.π-комплексите са сложни съединения, в които като лиганди се появяват ненаситени органични молекули като етилен, циклопентадиен, бензен и др. Най-известният пример за такива комплекси е фероцен - бис(циклопентадиенил)желязо със състав [Fe(C5H5)2]. Структурата на това съединение наподобява сандвич или сандвич. Комплексообразователят - Fe (II) се намира между цикличните аниони С5Н5 - - на еднакво разстояние от всички въглеродни атоми. Отделни ковалентни връзки между комплексообразуващия агент и атомите на лиганда не могат да бъдат изолирани в бис(циклопентадиенил)желязото: централният атом образува връзка с цялата пи-електронна система на лиганда.

Хелати или циклични комплексни съединения. Хелатите се наричат комплексни съединения, чиято вътрешна сфера се състои от циклични групи, включително комплексообразуващ агент. Например, α-аминооцетната киселина (глицин) може да реагира с меден хидроксид, за да образува синьо-виолетов силен комплекс, който е разтворим във вода:
Вътрешната сфера на комплекса съдържа два затворени петчленни цикъла и следователно полученият комплекс е много стабилен.
многоядрени комплекси. Ако сложен йон или неутрален комплекс съдържа два или повече комплексообразуващи агента, тогава този комплекс се нарича многоядрен.Сред многоядрените комплекси се разграничават мостови, клъстерни и многоядрени комплекси от смесен тип.
Атомите на комплексообразователя могат да бъдат свързани помежду си с помощта на мостови лиганди, функциите на които се изпълняват от йони OH-, Cl-, NH2-, O22-, SO42- и някои други. Така в комплексното съединение [Pt2(NH3)2Cl4] и [Pt2Br4] монодентатните хлоридни и бромидни йони служат като мостове.
Мостовият лиганд може да бъде полидентен лиганд с няколко донорни атома (например NCS-- с N и S атоми, способни да участват в образуването на връзки чрез донорно-акцепторния механизъм), или лиганд с няколко електронни двойки при един и същ атом (например Cl- или OH-).
В случай, че атомите на комплексообразователя са директно свързани, многоядреният комплекс се класифицира като клъстерен тип. По този начин клъстерът е комплексният анион [Re2Cl8]2–, в който се реализира четворната връзка Re-Re: σ-връзка, 2π-връзки и δ-връзка. Особено голям брой клъстерни комплекси се срещат сред производните на d-елементите.
Многоядрените комплекси от смесен тип съдържат както комплексно-комплексообразуваща връзка, така и мостови лиганди. Пример за комплекс от смесен тип е кобалтовият карбонил комплекс със състав [Co2(CO)8], където има единична Co-Co връзка и два бидентатни CO карбонилни лиганда, които свързват комплексообразуващите атоми.
Имена на мостови групи и многоядрени комплекси. Името на мостовите групи се предхожда от гръцката буква μ (mu), която се повтаря преди името на мостовия лиганд на всеки вид. При изброяване на лиганди, мостовите лиганди първо се наименуват в реда на тяхното усложнение, след това немостовите лиганди в пълно съответствие с предварително установенияред, а след това - комплексообразователи с посочване на броя им. Ако в комплекса има идентични фрагменти, това може да бъде отразено и в името.