6) Извеждане на 32 класа на симетрия
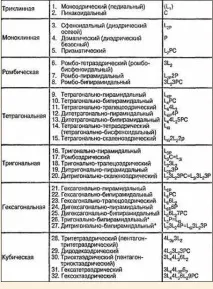
Разпределителна ел.яч. чрез сингонии. Разбиването на 32 класа кристална симетрия в групи според сходството на симетрията води до концепцията засингонияиликристалографска система, която е много важна за минералогията и кристалографията. Кристалите от една и съща сингония са обединени от един и същ набор от характерни ъгли и наличието на един или повече идентични елементи на симетрия (по-специално, главната ос или набор от оси от същия ред).Разграничават се общо седем сингонии; по ред на нарастваща симетрия това са триклинни, моноклинни, ромбични, тетрагонални, тригонални и хексагонални (често, особено в чужбина, те се комбинират в едно -шестоъгълни), както и кубични системи.
Координационен номер на структурни звена.Координационното числое броят на лигандните атоми, директно свързани към централния атом. (броят на най-близките съседи)
K.Ch=3-триъгълник K.Ch=2-диедър K.Ch=4-тетраедър K.Ch=6-октаедър K.Ch=8-куб K.Ch=12-кубооктаедър.
Координационен полиедър - ако центровете на съседни атоми са свързани с прави линии, се получава км (диедър, триъгълник, тетраедър, октаедър, куб, кубоктаедър).
Броят на атомите в клетката. Броят на атомите се брои, за да се напише стехиометричната формула.
връх-1/8, ръб-1/4, лице-1/2, вътрешен ел. клетка-цяло.
8)Степента на запълване на пространството със структурни единици-Av-степента на запълване с материални частици ел. клетка (фактор на компактност).
z- брой материални единици
Видове кухини в решетките. Когато два плътно опаковани слоя A и B се наслагват, се образуват 2 вида кухини: тетраедрични c.c. = 4 и октаедрични c.c. = 6 9)Размерите на атомите и йоните. Ефективни и валидни размери. Зависимостта от позицията им вгрупи от периодичната система. Поляризация на атомите.
В групите на периодичната система размерите се увеличават поради увеличаване на броя на орбиталите в периоди, радиусът намалява с увеличаване на техните заряди, тъй като с увеличаването на броя на отдалечените електрони ядрото привлича електрони с по-голяма сила. В kx е обичайно да се използват не орбитални радиуси (те показват разстоянието от ядрото до максимума на орбиталната обвивка), а ефективни радиуси (това е обхватът на атома, т.е. минималното разстояние, на което центровете на сферите на атомите могат да се доближат до повърхността на сферите на съседните атоми).
Стойността на радиуса варира в зависимост от поляризационната способност на атомите. Поляризиращата способност е способността на йона да се деформира под действието на външно електростатично поле, измествайки позицията на ядрото спрямо обвивката.
10. Кристална структура. Молекулярни ковалентни метални йонни кристали.
Кристална структурае такъв набор от атоми, в който определена група атоми, наречена мотивна единица, е свързана с всяка точка на кристалната решетка и всички такива групи са идентични по състав, структура и ориентация спрямо решетката. Можем да предположим, че структурата възниква в резултат на синтеза на решетката и мотивната единица, в резултат на умножаването на мотивната единица от преводната група.
В най-простия случай мотивната единица се състои от един атом, например в кристали от мед или желязо. Структурата, която възниква на базата на такава мотивна единица, е геометрично много подобна на решетка, но въпреки това се различава по това, че е съставена от атоми, а не от точки. Често това обстоятелство не се взема предвид и термините "кристална решетка" и "кристална структура" за такива кристали се използват като синоними, което не е строго. В тези случаикогато мотивната единица е по-сложна по състав - състои се от два или повече атома, няма геометрично сходство на решетката и структурата и объркването на тези понятия води до грешки. Например структурата на магнезия или диаманта не съвпада геометрично с решетката: в тези структури мотивните единици се състоят от два атома.
Основните параметри, които характеризират кристалната структура, някои от които са взаимосвързани, са следните:
тип кристална решетка (сирингония, решетка на Браве);
броя на формулните единици на елементарна клетка;
параметри на елементарната клетка (линейни размери и ъгли);
координати на атоми в клетка;
координационни числа на всички атоми.
Видове химични връзки в кристали. В зависимост от естеството на частиците и естеството на силите на взаимодействие в кристалите има четири вида химични връзки: ковалентни, йонни, метални и молекулярни.
Кристалите с ковалентна връзка са диелектрици или полупроводници. Типични примери за атомни кристали са диамант, германий и силиций.
Положително и отрицателно заредени йони са разположени във възлите на кристалната решетка.
Силите на взаимодействие между възлите са предимно електростатични (Coulomb). Връзката между такива частици се нарича хетерополярна или йонна.
Йонните кристали са изолатори при ниски температури. При температури, близки до точката на топене, те стават проводници на електричество. Пример за кристали с йонна решетка са кристалите от каменна сол (NaCl).
Специален тип връзка, характерна за метала и металидите. Положителните метални йони са разположени във всички възли на кристалната решетка. Между тях се движат хаотично, подобно на газови молекуливалентните електрони се отделят от атомите по време на образуването на йони. Тези електрони играят ролята на цимент, задържайки положителните йони заедно; в противен случай решетката би се разпаднала под действието на отблъскващи сили между йоните. В същото време електроните също се задържат от йони в кристалната решетка и не могат да я напуснат. Комуникационните сили не са локализирани и ненасочени. Следователно в повечето случаи се появяват високи координационни числа (например 12 или 8). Свободно движещите се електрони причиняват висока електрическа и топлопроводимост.
Повечето метали имат кристални решетки от един от трите типа: обемно-центрирана кубична, лицево-центрирана кубична и така наречената плътна шестоъгълна.
Във възлите на кристалната решетка се разполагат ориентирани по определен начин молекули. Силите на свързване между молекулите в кристала са от същото естество като силите на привличане между молекулите, което води до отклонение на газовете от идеалността. Поради тази причина те се наричат сили на Ван дер Ваалс.
Кристалите с молекулни връзки се характеризират с ниски точки на топене и висока свиваемост.