Ацетилен – Уикипедия.
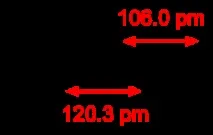 |
 |
| Етин |
| ацетилен |
| C2H2 |
| 26,038 [1] g/mol |
| 1.0896 g/l |
| 11,4 ± 0,1 eV [2] |
| -80.8 1277 mm Hg °C |
| −119 ± 1 градус по Фаренхайт [2] |
| -83,6°C |
| 335°С |
| 2,5 ± 0,1 об.% [2] |
| −80,55 |
| 35,2°С; 6,4 MPa |
| 44,036 J/(mol K) |
| +226,88 kJ/mol |
| –1302 kJ/mol |
| 44,2 ± 0,1 atm [2] |
| 100 18 мл/100 мл |
| 600 18 ml/100 ml |
| sp |
| 74-86-2 |
| 6326 |
| 200-816-9 |
| AO9600000 |
| 27518 |
| 1001 |
| 6086 |
| Данните се основават на стандартни условия (25 °C, 100 kPa), освен ако не е отбелязано друго. |
Съдържание
В лабораторията
В лабораторията, както и в оборудването за газово заваряване, ацетиленът се получава чрез въздействието на вода върху калциев карбид [3] (F. Wöhler, 1862),
C a C 2 + 2 H 2 O →C a ( O H ) 2 + C 2 H 2 ↑ +2H_O\rightarrow Ca(OH)_+C_H_\uparrow >>>
както и по време на дехидрогенирането на две молекули метан при температури над 1400 °C:
2 C H 4 → C 2 H 2 + 3 H 2 \rightarrow C_H_+3H_>>>
В индустрията
В промишлеността ацетиленът се получава чрез хидролиза на калциев карбид и пиролиза на въглеводородни суровини - метан или пропан с бутан. В последния случай ацетиленът се получава заедно с етилен и примеси от други въглеводороди. Карбидният метод дава възможност за получаване на много чист ацетилен, но изисква висока консумация на енергия. Пиролизата е значително по-малко енергоемка, т.к реакторът се нагрява чрез изгаряне на същия работен газ във външната верига, но концентрацията на самия ацетилен в газовия поток от продукти е ниска. Изолирането и концентрирането на индивидуалния ацетилен в този случай е трудна задача. Икономическите оценки и на двата метода са многобройни, но противоречиви [4] [:стр. 274].
Получаване чрез пиролиза
електрокрекинг
Метанът се превръща в ацетилен и водород в електродъгови пещи (температура 2000-3000 ° C, напрежение между електродите 1000 V). В същото време метанът се нагрява до 1600 °C. Консумацията на електроенергия е около 13 000 kWh на 1 тон ацетилен, което е сравнително високо (приблизително равно на изразходваната енергия при карбидния метод) и следователно е недостатък на процеса. Добивът на ацетилен е 50%.
Регенеративна пиролиза
Друго име е процесът на Волф. Първо, главата на пещта се нагрява чрез изгаряне на метан при 1350–1400°C. След това метанът преминава през нагрята дюза. Времето на престой на метана в реакционната зона е много кратко и възлиза на части от секундата. Процесът е внедрен в промишлеността, но икономически не се оказва толкова обещаващ,както се разглежда на етапа на проектиране.
Окислителна пиролиза
Метанът се смесва с кислород. Част от суровината се изгаря, а получената топлина се изразходва за нагряване на останалата част от суровината до 1600 °C. Добивът на ацетилен е 30–32%. Методът има предимства - непрекъснат характер на процеса и ниска консумация на енергия. В допълнение, синтез газ също се образува с ацетилен. Този процес (процес на Zachse или процес на BASF) е получил най-широко разпространение.
Хомогенна пиролиза
Това е вид окислителна пиролиза. Част от суровината се изгаря с кислород в пещта на пещта, газът се нагрява до 2000 °C. След това останалата част от суровината, предварително загрята до 600 °C, се вкарва в средната част на пещта. Образува се ацетилен. Методът се характеризира с по-голяма безопасност и надеждност на пещта.
Пиролиза в струя нискотемпературна плазма
Процесът е разработен от 70-те години на миналия век, но въпреки обещанието все още не е въведен в индустрията. Същността на процеса е нагряването на метан от йонизиран газ. Предимството на метода е относително ниската консумация на енергия (5000–7000 kWh) и високите добиви на ацетилен (87% в аргонова плазма и 73% във водородна плазма).
Карбиден метод
Този метод е известен от 19 век, но не е загубил значението си до днес. Първо, калциевият карбид се получава чрез сливане на калциев оксид и кокс в електрически пещи при 2500–3000 °C:
C a O + 3 C → C a C 2 + C O ↑ +CO\uparrow >>>
C a C O 3 → C a O + C O 2 ↑ \rightarrow CaO+CO_\uparrow >>>
След това калциевият карбид се третира с вода:
C a C 2 + 2 H 2 O → C 2 H 2 + C a ( O H ) 2 +2H_O\rightarrow C_H_+Ca(OH)_>>>
Полученият ацетилен има висока степен на чистота от 99,9%. Основният недостатък на процесае високата консумация на електроенергия: 10 000-11 000 kWh на 1 тон ацетилен.
Физични свойства
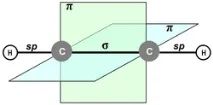
При нормални условия той е безцветен газ, по-лек от въздуха. Чистият 100% ацетилен е без мирис. Техническият ацетилен се съхранява в цилиндри с порест пълнител, импрегниран с ацетон (тъй като чистият ацетилен експлодира при компресиране), и може да съдържа други примеси, които му придават остра миризма [5] . Слабо разтворим във вода, разтворим в ацетон. Точка на кипене −83,6 °C [6] . Тройна точка −80,55°C при 961,5 mmHg чл., критична точка 35,18 °C при налягане 61,1 atm [7] .
Ацетиленът изисква голямо внимание при боравене. Може да експлодира при удар, при нагряване до 500 °C или при компресиране над 0,2 MPa [8] при стайна температура. Струя ацетилен, пусната на открито, може да се запали от най-малката искра, включително от изхвърлянето на статично електричество от пръст. Ацетиленът се съхранява в специални цилиндри, пълни с порест материал, импрегниран с ацетон [9] .
Ацетиленът се намира на Уран и Нептун.
Химични свойства

- Ацетиленът (етин) се характеризира с реакции на присъединяване:
Ацетиленът с вода, в присъствието на живачни соли и други катализатори, образува ацеталдехид (реакция на Кучеров). Поради наличието на тройна връзка, молекулата е високоенергийна и има висока специфична топлина на изгаряне – 14 000 kcal/m³ (50,4 MJ/kg). При изгаряне в кислород температурата на пламъка достига 3150 °C. Ацетиленът може да полимеризира до бензен и други органични съединения(полиацетилен, винилацетилен). Полимеризацията до бензен изисква графит и температура от
500°C. В присъствието на катализатори като никелов трикарбонил (трифенилфосфин) температурата на реакцията на циклизация може да бъде понижена до 60–70°C.
В допълнение, водородните атоми на ацетилена са относително лесни за отделяне под формата на протони, тоест той проявява киселинни свойства. Така ацетиленът измества метана от етерен разтвор на метилмагнезиев бромид (образува се разтвор, съдържащ ацетилениден йон), образува неразтворими експлозивни утайки със соли на сребро и едновалентна мед.
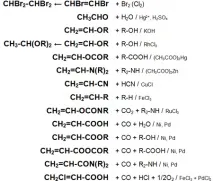
Основните химични реакции на ацетилена (реакции на присъединяване, обобщена таблица 1.):
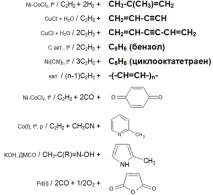
Основните химични реакции на ацетилена (реакции на добавяне, димеризация, полимеризация, цикломеризация, обобщена таблица 2.):
Ацетиленът обезцветява бромната вода и разтвора на калиев перманганат.
Реагира с амонячни разтвори на Cu(I) и Ag(I) соли, за да образува слабо разтворими, експлозивни ацетилениди - тази реакция се използва за качествено определяне на ацетилена и разграничаването му от алкени (които също обезцветяват бромната вода и разтвора на калиев перманганат).
Открит през 1836 г. от E. Davy, синтезиран от въглища и водород (дъгов разряд между два въглеродни електрода във водородна атмосфера) от M. Berthelot (1862).
Приложение

- за газово заваряване и рязане на метали,
- като източник на много ярка, бяла светлина в самостоятелни осветителни тела, където се получава чрез реакцията на калциев карбид и вода (вижте карбидна лампа),
- в производството на експлозиви (виж ацетилиди),
- за производство на оцетна киселина, етилов алкохол, разтворители, пластмаси, каучук, ароматни веществавъглеводороди.
- за производство на сажди
- в атомно-абсорбционната спектрофотометрия по време на пламъчно атомизиране
- в ракетни двигатели (заедно с амоняк) [10]
Безопасност

Тъй като ацетиленът е неразтворим във вода и неговите смеси с кислород могат да експлодират в много широк диапазон от концентрации, той не може да се събира в газомери.
Ацетиленът експлодира при температура около 500 ° C или налягане над 0,2 MPa; CPV 2,3-80,7%, температура на самозапалване 335 °C. Експлозивността се намалява чрез разреждане на ацетилена с други газове, като азот, метан или пропан.
При продължителен контакт на ацетилена с мед и сребро се образуват медни и сребърни ацетилениди, които експлодират при удар или повишаване на температурата. Следователно, когато се съхранява ацетилен, не се използват материали, съдържащи мед (например цилиндрични клапани).
Ацетиленът има лек токсичен ефект. За ацетилен, MPCm.r. = MPC s.s. = 1,5 mg/m³ съгласно хигиенните норми GN 2.1.6.1338-03 "Пределно допустими концентрации (ПДК) на замърсители в атмосферния въздух на населените места".
МПКр.з. (работна зона) не е установена (съгласно GOST 5457-75 и GN 2.2.5.1314-03), тъй като границите на концентрация на разпространение на пламъка в смес с въздух са 2,5–100%.
Съхранява се и се транспортира в бели стоманени цилиндри, пълни с инертна пореста маса (например въглен) (с червен надпис "А") под формата на разтвор в ацетон под налягане 1,5-2,5 MPa.