Аяпбергенов Е
Сероводородните газове, образувани по време на пречистването на въглеводородни газове от киселинни компоненти, обикновено се преработват в сярна киселина или елементарна сяра. За оползотворяване на газообразния сероводород в елементарна сяра обикновено се използва добре познатият в световната практика процес на Клаус или неговите различни модификации. В момента почти целият обем на промишленото производство на сяра се получава на базата на този процес. Използването на сяра от преработен нефт е от голямо значение за околната среда [1, 2].
Същността на процеса на Клаус е преработката на сероводородния газ в сяра чрез окислителен метод с помощта на термични и два или три каталитични етапа [3].
Киселинният газ, доставен в инсталацията на Клаус, се подлага на високотемпературно (900 - 1300°C) изгаряне в свободен пламък в присъствието на стехиометрично количество въздух, за да се получи елементарна сяра (добив до 70%) и серен диоксид в съответствие с уравненията [4]:
, (1)
. (2)
Общоприето е, че при стехиометрично количество кислород в пещта, част от H2S реагира съгласно реакция (1), а една трета от нереагиралия H2S реагира съгласно реакция (2). Следователно на изхода на пещта в газовете съотношението H2S / SO2 е равно на 2.
Въпреки това изглежда по-правилно да се образува сяра чрез серен оксид. Тогава механизмът на пламъчно изгаряне на сероводород ще бъде изразен със следните уравнения:
, (3)
, (4)
, (5)
Реакциите (3) и (4) протичат с висока скорост, така че добивът на сяра ще бъде ограничен от скоростта на реакция (5).
Полученият по реакция (2) серен диоксид се окислява върху бокситен катализатор с хидроаргилитна структура при температура 370–400°C съгласно реакциите:
, (6)
, (7)
Реакцията протича отчасти на термичния етап, когато газовият поток се охлажда, но в по-голяма степен на етапа на каталитично окисление.
Въздухът се подава към горивната камера по такъв начин, че съотношението H2S:SO2 на изхода на пещта е 2:1 (в съответствие с последващото каталитично окисление на сероводород със серен диоксид). Съдържанието на кислород в отделящите се газове трябва да бъде сведено до минимум, тъй като присъствието му допринася за сулфатирането на катализатора на основата на алуминиев оксид.
Във всички етапи на процеса се търси степента на преобразуване на сероводорода да се доведе до състояние на термодинамично равновесие. Равновесното превръщане на сероводород в сяра в температурния диапазон 150 ÷ 1300°C е показано на фигура 1.
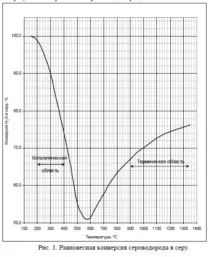
Фигура 1. - Температурна зависимост на термодинамично равновесната степен на превръщане на H2S в парообразна елементарна сяра
В процеса на Клаус реакциите протичат в три зони: 1 - високотемпературна (над 800 ° C), където превръщането на H2S в сяра достига 70 - 80% и се увеличава с повишаване на температурата, тъй като сероводородът започва да се разлага на елементи; 2 - преходна зона, в която намаляването на добива на сяра при температура 530 - 730 ° C се дължи на свързването на сяра от тип S2 в видове с по-високо молекулно тегло S4, S6, S8; 3 - нискотемпературна каталитична зона, в която понижаването на температурата повишава степента на превръщане.
Пламъчните реакции водят до превръщане на сероводорода в елементарна сяра, образуване на серен диоксид и разрушаване на примеси, които биха могли да дезактивират катализатора. Сярата се образува под формата на S1-2 във високотемпературната зона на пламъка и S3-8 в нискотемпературната зона [5–7].
Наличие в киселия газ т.нарнежеланите компоненти (CO2, водна пара и въглеводороди) могат да влязат в странични реакции, водещи до намаляване на превръщането на сероводорода в сяра и образуването на съединения, които могат да влязат в реакции за образуване на сяра в следващите (каталитични) етапи на процеса [8]:
Въглеводородите изгарят с образуването на CO2, CO, H2O, H2. При високи температури в пламъка, в резултат на взаимодействието на въглеводороди със серни пари, се образува въглероден дисулфид:
,
,
.
Свободният водород, образуван по време на термичната дисоциация на сероводорода, редуцира въглеродния диоксид до оксид, който, взаимодействайки със сярата, образува въглероден сулфид:
;
;
.
Тъй като температурата на газа намалява, реакцията протича в обратна посока с образуването на сероводород, но скоростта на обратната реакция се забавя с намаляване на температурата. За пълно превръщане на въглеродния сулфид е необходимо да се извърши на катализатор при температура не по-ниска от 350 ° C. Бокситният катализатор, който се използва за контактно окисляване на сероводород, може също да бъде ефективен за превръщането на въглероден сулфид, но най-високото превръщане ще бъде в случай на използване на активен Al2O3:
;
.
В това отношение най-често срещаната схема е с два каталитични етапа. При преобразуване на газове, съдържащи въглероден сулфид, температурата, до която трябва да се нагреят газовете, влизащи в конвертора на 1-ви етап, се приема, че е 230 - 280 ° C, така че температурата на газовете на изхода на 1-ви конвертор да е най-малко 350 ° C, за да се постигне пълнотата на реакциите на взаимодействие на COS и SO2.
Изследването на механизма на образуване на въглероден дисулфид и въглероден сулфид показа, че те се образуват автономно. образованиевъглеродният дисулфид допринася главно за ароматни въглеводороди.
Поради високото съдържание на водни пари в газа, получен на термичния етап и влизащ в каталитичния конвертор, CS2 и COS се хидролизират частично в присъствието на катализатори на процеса. Скоростта на хидролиза се увеличава с повишаване на температурата в конвертора (например скоростта на хидролиза на CS2 се удвоява приблизително на всеки 20°C). Температурата на изхода на първия конвертор се поддържа в рамките на 320–360 ° C, докато степента на преобразуване на COS достига 90%, CS2 - 70–75% (въпреки това, загубата на сяра под формата на CS2 и COS е много забележима).
Наличието на амоняк в киселинния газ, влизащ в инсталацията, ако той преминава изцяло или частично през пещта без изгаряне, също води до вторични реакции, образуването (поради реакция със сяра) на отлагания на твърди амониеви комплекси в най-студените части на инсталацията, възможното образуване на азотен оксид в присъствието на кислород, което допринася за окисляването на серен диоксид до триоксид. Последният, когато взаимодейства с вода, образува сярна киселина, която заедно с проблемите с корозията засилва сулфатирането на катализатора - алуминиев оксид. За да се предотвратят тези реакции, е необходимо да се отстрани амонякът от захранващия поток на етапа на термично изгаряне [5, 6].
;
;
;
.
Сярата е по-малко летлива от другите компоненти на газовата смес, така че се отстранява от технологичния поток чрез кондензация след реакционната пещ и всеки каталитичен конвертор. Това позволява да се измести реакционното равновесие към образуването на сяра и да се намали точката на оросяване на сярата в газовете, което от своя страна прави възможно понижаването на температурата в каталитичните конвертори, избягвайкиотлагане на сяра върху катализатора. Този принцип е в основата на работата на каталитичните етапи на инсталациите на Клаус.
Въз основа на термодинамични изчисления някои изследователи препоръчват използването на три или четири каталитични конвертора, работещи при стационарни условия при много ниска температура. В този случай е възможно да се постигне превишаване на общия добив на сяра. При съвременната технология обаче тези резултати не се постигат поради кинетични ограничения, например поради отлагането на сяра в порите на катализатора [10].