Бензоиева киселина
Парацетамол (парацетамол). Парацетамол
Описание: Бял или бял с кремав или розов оттенък кристален прах без мирис.
Разтворимост:умерено разтворим във вода, свободно разтворим в 95% алкохол, разтворим в ацетон и каустични алкални разтвори, практически неразтворим в етер.
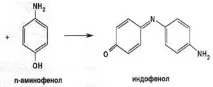
Нереагиралият пара-аминофенол, когато взаимодейства с хинонимин, образува индофенол;
Чистота: киселинността се определя чрез HPC (появява се поради разлагането на лекарството и освобождаването на оцетна киселина), наличието на първоначалния продукт от синтеза на пара-аминофенол, загуба на тегло при сушене.
Допустими примеси: сулфатна пепел и тежки метали, сулфати и хлориди са в рамките на стандарта.
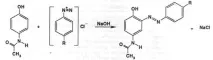
Съгласно FS се провеждат тестове за примеси на междинни продукти от синтеза (пара-хлороацетанилид и пара-аминофенол) чрез TLC върху плочи Silufol UV-254 със стандартни проби от примеси. Проверката на резултатите се извършва в UV светлина при дължина на вълната 254 nm. Пара-аминофенолът се определя чрез реакция в сравнение с проба от парацетамол, която няма примеси. Полученият цвят на тестовата проба не трябва да бъде по-интензивен от контролния разтвор.
Количествено определяне: предложени са много методи, включително неутрализация след хидролиза на освободената оцетна киселина; парацетамолът проявява слабо киселинни свойства, поради което може да се определи чрез неводно титруване в безводен ацетон, титрантът е калиев хидроксид в изопропилов алкохол. В този случай точката на еквивалентност се задава потенциометрично.
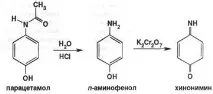
Съгласно GPC нитритометричен метод, според продукта на киселинна хидролиза (пара-аминофенол хидрохлорид). Пара-аминофенолът, образуван след 1 час кипене под обратен хладник, се титрува с натриев нитрит в среда на солна киселина свъншен индикатор нишестена йодна хартия:
NaNO2 + HCIà NaCl + HNO2
Първо, натриевият нитрит отива до образуването на сол на пара-хидроксибензендиазониев хлорид. В точката на еквивалентност (когато в разтвора не е останал пара-аминофенол), излишъкът от натриев нитрит реагира с калиев йодид (съдържащ се в нишестена йодирана хартия), освобождава се йод, който незабавно оцветява нишестето на външния индикатор:
2NaNO2 + 2KI + 4HC1 à I2 + 2NO + 2KC1 + 2H2O+2NaC1
Следователно реакцията на образуване на диазониева сол протича във времетонеобходимо е да се титрира според метода, бавно. За да се стабилизира нестабилната диазониева сол, калиев бромид се добавя към разтвора преди титруване, а самото титруване се извършва при температура не по-висока от 20 0 С.
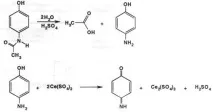
Излишъкът от цериев сулфат (IV) взаимодейства с добавения 10% разтвор на калиев йодид с освобождаване на свободен йод. Свободният йод се титрува с 0,1 М разтвор на натриев тиосулфат (индикатор - нишесте):
В таблетките FS парацетамолът се определя спектрофотометрично при 257 nm (максимум на абсорбция) в 0,1 М разтвор на калиев хидроксид.
Съхранение: съгласно списък B; в добре затворен съд на сухо място, защитено от светлина, за да предизвика хидролиза. W.r.d. вътре 0,5 g; w.s.d. вътре 1,5 g.
Употреба: Антипиретик, аналгетик.
Форма на освобождаване: прах, таблетки от 0,2 и 0,5 g, сиропи, множество многокомпонентни лекформи, съдържащи парацетамол.
Ароматни киселини и техните соли
Ароматните киселини са производни на ароматни въглеводороди, в които един или повече водородни атоми в бензеновия пръстен са заменени с карбоксилни групи. Най-простият представител на хомоложната серия е бензоената киселина, тя е малко по-слаба в киселинните свойства на оцетната киселина. Салициловата киселина, която има фенолен хидроксил в състава си, е много по-силна от оцетната киселина. При взаимодействие с алкали бензоената и салициловата киселина образуват соли, които са силно разтворими във вода. Във водни разтвори те се дисоциират като соли на слаби киселини и силни основи. Синтезирайте бензоената киселина по няколко начина. Вероятно окислениетолуен с различни окислители:
По-модерен метод за получаване се основава на течнофазовото окисление на толуен с атмосферен кислород при 150 0 С и повишено налягане:
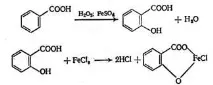
Салициловата киселина се получава чрез карбоксилиране на фенол:
Суха смес от фенол и натриев хидроксид се нагрява до 130 0 С при налягане 5 атмосфери с въглероден диоксид. След това реакционният продукт се разтваря във вода и се подкислява със солна киселина. Салициловата киселина се прекристализира.
Бензоиева киселина. Бензоена киселина
Описание: Безцветни игли или бял фин кристален прах. При нагряване сублимира; дестилиран с водна пара.
Разтворимост:Слабо разтворим във вода, разтворим във вряща вода, свободно разтворим в алкохол, хлороформ, етер и бензен, разтворим в мастни масла.
Автентичност:според GPC реагира с разтвор на железен (III) хлорид. Киселината се разтваря предварително в 0,1 М разтвор на натриев хидроксид до неутрално състояние. Резултатът от реакцията е неразтворим във вода основен железен бензоат с розово-жълт цвят:
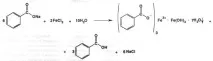
Чистота: GPC също предлага тестване на бистротата и цвета на разтвора.FS предлага да се определи микробиологичната чистота.
Допустими примеси: ограничава наличието на редуциращи вещества, лесно овъгляващи се примеси (съгласно цветовия стандарт 5 a - 5 g), хлориди, сулфати, сулфатна пепел трябва да издържат тестове за тежки метали.
Количествено определяне: съгласно HPC лекарството се разтваря в алкохол, неутрализиран с фенолфталеин и се титрува със същия индикатор с натриев хидроксид до получаване на розов цвят. Активното вещество в препарата трябва да бъде най-малко 99,5%.
Съхранение: в добре затворен контейнер (летлив).
Употреба: като лек антисептик в мехлеми. По-често се използва натриева сол.
Натриеви бензои. Натриев бензоат
Получаване:чрез реакция на неутрализация на бензоена киселина със сода:
Описание: Бял кристален прах без мирис, сладникаво-солен вкус.
Разтворимост: лесно разтворим във вода, трудно разтворим в алкохол.
Автентичност: според HFC - 1) препаратът дава характерна реакция а) на натрий, оцветявайки безцветен пламък в жълто б) на бензоати - с железен (III) хлорид се утаява утайка с телесен цвят. 2) лекарството се разтваря във вода, добавя се 1 ml азотна киселина; отделените бели кристали бензоена киселина се отфилтруват, изсушават се в ексикатор и се определя точката на топене (120-124,5°С). Характерна, но нефармакопейна реакция е взаимодействието с 5% разтвор на меден сулфат - утаява се тюркоазена утайка.Чрез FS идентификацията се извършва чрез UV спектрофотометрия в областта от 220-230 nm във воден разтвор; трябва да има максимум на абсорбция при 226 nm.
GPC предлага да се направят тестове за прозрачност и цвят на разтвора, алкалност и киселинност, загуба на тегло при изсушаване.FS предлага да се определи микробиологичната чистота.
Допустими примеси: хлориди, сулфати, тежки метали.
Количествено определяне:чрез ацидиметричен метод. Титрантът е солна киселина, индикаторът е смес от метилоранж иметиленово синьо. Титруването трябва да се извърши в присъствието на етер, който извлича получената бензоена киселина в етерния слой. Тъй като в разтвор, достатъчно силна бензоена киселина ще промени pH на водния разтвор към киселинната страна, което значително ще изкриви резултатите от титруването:
Съхранение: в добре затворен съд.