ЕФЕКТ НА РАЗЛИЧНИ КОМПОНЕНТИ НА СРЕДАТА ЗА КУЛТИВИРАНЕ ВЪРХУ ПРОИЗВОДСТВОТО НА РЕКОМБИНАНТНИ АНТИТЕЛА В CHO
През последните години броят на рекомбинантните антитела, одобрени за терапевтична употреба, непрекъснато нараства. Нарастващите изисквания за производство на фармацевтични продукти от биологичен произход стимулират развитието на изследвания, насочени към увеличаване на производителността на клетъчни линии на бозайници, които получават повече от 60% рекомбинантни терапевтични протеини. Въпреки развитието на други методи на експресия, биосинтезата на терапевтични протеини в клетки на бозайници остава приоритетният избор, тъй като позволява получаването на биологично активни протеини в нативната конформация поради правилно сгъване и пост-транслационна модификация. Една от най-често срещаните клетъчни линии на бозайници във фармацевтичната индустрия е клетъчната линия CHO (яйчник на китайски хамстер), която е най-проучваният и стабилен обект в производството на рекомбинантни протеини в продължение на много години. Предимството на използването на СНО клетки пред други клетки като NS0 (мишеми миеломни клетки), BHK (бъбречни клетки на бебе хамстер), HEK-293 (човешки ембрионални бъбречни клетки) е тяхното добро представяне при трансфекция, по-нататъшно усилване и селекция на високопроизводителни клонове. В допълнение, СНО клетките имат способността да дават висока плътност, когато се отглеждат в суспензия, без да образуват клъстери и да се утаяват на дъното [7]. Наред с подобряването на промишлените методи за получаване на протеини, от голямо значение е разработването на експресни методи за повишаване на нивото на производство на рекомбинантни протеини по време на култивиране в лабораторни условия. Един от начините за увеличаване на експресията на желания продукт е използването на различни добавки към хранителната среда.
Един от положителните факторие изкуственото създаване на "стресови" условия на отглеждане [3]. Но такова излагане се извършва само след като клетъчната култура достигне оптималната концентрация. От особено значение за получаване на висока продуктивност на клетъчни линии са разработките за използването на различни добавки, като натриева сол на валпроева киселина (Na-VPA) или нейния аналог, натриев бутират (NaBu), както и цинкови соли.
Na-VPA или NaBu соли се използват широко за получаване на висока експресия на рекомбинантни протеини [3]. Един от най-очевидните фактори, водещи до тези резултати, е ацетилирането на хистони. Ацетилирането на ядрените хистони има голям ефект върху сглобяването на хроматина, но също така инхибира клетъчния растеж и индуцира клетъчна апоптоза [4].
Предполага се, че цинкът блокира апоптозата в човешките клетки при определени условия [5] и също така допринася за повишаване на стабилността на иРНК или чрез промяна на вторичната структура, или чрез улесняване на прикрепването на стабилизиращи протеини към иРНК [1, 2]. Положителни резултати са постигнати с ниски концентрации на цинков сулфат. Това е особено демонстрирано за производството на рекомбинантен интерферон-гама. Наличието на добавки като ZnSO4 и NaBu, съчетано с намаляване на температурата на растеж, може да увеличи добива на продукти от 2 до 8 пъти [9].
Също така, един от необходимите компоненти на средата за отглеждане на клетки от бозайници е глутаминът. Метаболизмът на глутамин обаче причинява натрупване на амоний в клетъчната култура. Увеличаването на концентрацията на амоний над 2 mM има отрицателен ефект както върху клетъчния растеж, така и върху продуктивността на рекомбинантните протеини. Намаляването на концентрацията на глутамин в СНО клетъчната растежна среда подобрява жизнеспособността на клетките,и, като следствие, производството на рекомбинантни протеини [6]. Удължаването на периода на жизнеспособност на клетките е свързано с потискане на растежа и спиране на клетъчния цикъл, което е потвърдено от молекулярни изследвания.
Цел на изследването
Изследване на ефекта на натриева сол на валпроева киселина, цинков сулфат и глутамин върху експресията на рекомбинантни антитела в СНО клетки.
Материали и методи
Суспензионната клетъчна линия CHO DG44 беше трансфектирана с трансфекционния реагент FreeStyle Max Reagent (Invitrogen). За трансфекция бяха използвани плазмидите pOptiVEC-L и pcDNA3.3-H, съдържащи гените за леките и тежките вериги на химерното анти-TNF-алфа антитяло. Клетките след трансфекция се отглеждат върху селективна среда без серум CD OptiCHO. Клетъчната концентрация и жизнеспособността се измерват с помощта на 0,04% разтвор на трипаново синьо в камера на Goryaev. При достигане на клетъчна плътност от 1.7x106 клетки/ml и 90% жизнеспособност, клетките се посяват в 30 ml пълна CD OptiCHO среда при концентрация от 1x105 клетки/ml във флакони от 125 ml.
След 48 часа култивиране при 37°С, 8% CO2, 130 rpm, към културата се добавя стерилен 25 mM Na-VPA разтвор в DMSO до крайна концентрация 0; 2.0; и 2.5 тМ. Добавя се стерилен 2 mM разтвор на цинков сулфат в 1x FBS разтвор при крайни концентрации от 0; 50; 100 цМ. Средата се сменя на всеки 2-3 дни.
Проби за анализ чрез ELISA са взети на 3-ия и 6-ия ден от инкубацията. Концентрацията на имуноглобулини в културалната среда се определя чрез индиректен сандвич ELISA по стандартния метод.
Анализ на преходна експресия на СНО адхезивна култура се извършва в IMDM среда в присъствието на 0.5% диализиран фетален говежди серум (DFBS).
За селекция на клонинги, които стабилно произвеждатантитела, ClonePix FL автоматичен флуоресцентен сортировач на клетки беше използван и CloneSelect Imager (и двата произведени от Genetix, UK) беше използван за оценка на сливането. Изборът на трансфектанти с най-добра експресия на антитела се извършва с помощта на клонова селекция върху полутвърда среда (Semi-Solid Media, Invitrogen, САЩ) съгласно метода, предложен от производителя.
Резултати и дискусия
ВлияниеNa-сол на валпроева киселина (Na-VPA), цинков сулфат и техните комбинации върху производството на антитела вCHO клетки.
Експерименти за изследване на ефекта на Na-VPA и цинков сулфат бяха проведени върху СНО клетъчна култура, временно експресираща рекомбинантни антитела срещу TNF-алфа. За да се определи ефектът на Na-VPA, клетките след трансфекция се отглеждат върху CD OptiCHO селективна среда без серум при концентрация от 1 х 105 клетки/ml във флакони от 125 ml. След 48 часа култивиране, Na-VPA се добавя към културата при крайна концентрация от 2.5 mM. Проби за анализ чрез ELISA са взети на 3-ия и 6-ия ден от инкубацията. Фигура 1 показва резултатите от ELISA на проби от среда, получени в присъствието на Na-VPA и при контролни условия (OptiCHO среда без добавки).
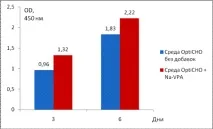
Фигура 1. Ефект на Na-VPA върху нивото на преходна експресия на антитела от СНО клетки
Добавянето на Na-VPA до крайна концентрация от 2,5 mM повишава продуктивността на суспензионната клетъчна култура с повече от 20% на дни 6-7 от инкубацията в сравнение с контролните условия. По-продължителното култивиране води до намаляване на производителността поради бърза клетъчна смърт.
Ефектът на цинков сулфат самостоятелно, както и в комбинация с Na-VPA, беше извършен върху прилепнали трансфектирани СНО клетки. След трансфекцията клетките се посяват в ямки от 24 ямкиплака в IMDM + 0.5% DFBS при 2 х 105 клетки на ямка. Когато клетките достигнат 90% сливане, средата се заменя с нова среда, съдържаща различни концентрации на Na-VPA и цинков сулфат. Проби за анализ чрез ELISA бяха взети след 48 часа инкубация с добавки.
Резултати от ELISA на проби от хранителна среда. маса 1