ЕЛЕКТРОЛИТНО ОКИСЛЕНИЕ НА ОРГАНИЧНИ СЪЕДИНЕНИЯ
Като метод на синтез електролитното окисление изглежда все още по-рядко срещано от електролитната редукция. Алифатните въглеводороди могат да бъдат окислени по следната схема:
За да се осигури достатъчно висок добив на желания продукт, е необходимо внимателно наблюдение на спазването на оптималните условия; освен това в много случаи други, добре доказани химически методи са по-ефективни.
Както в случая с електролитната редукция, натрупаните по-рано знания сега се допълват от по-задълбочени изследвания на механизма на реакцията. Първият етап на окисление може да бъде директен пренос на електрон за образуване на карбониев йон или свободен радикал, който след това реагира с друга атомна или молекулна частица от адсорбирания слой. На първия етап, директно окисление на „носителя“ („медиатора“), да речем, манганов (II) йон или
друго вещество, което лесно влиза в обратима окислително-редукционна реакция. В допълнение, разтворителят играе известна роля: във водна среда ОН йонът може да загуби електрон, превръщайки се в ОН радикал, който след това дава водороден пероксид или адсорбиран кислороден атом, или реагира директно с органична материя. И накрая, в случая на електрод от оловен диоксид, който често се използва като анод, самата повърхност на електрода участва в процеса на окисление.
Такъв процес на анодно окисляване като синтеза на въглеводороди според Колбе е известен отдавна, пример за което е електролизата на разтвор на ацетат на алкален метал с образуването на етан:
Това е често срещана реакция; за получаване на въглеводород може да се вземе и смес от две киселини. Методът е неподходящ в случай на ароматни и дикарбоксилни киселини, тъй като реакционният добив се влияе отсилно влияние на заместителите. Реакцията протича във водна и неводна среда по следната схема:
Въпреки това, някои характеристики на реакцията във воден разтвор изглежда показват, че в нея участват хидроксилни радикали или водороден пероксид, според механизъм като
Това е така наречената "пероксидна теория".
Реакцията на синтез според Колбе протича при висок аноден потенциал.
Анодното окисляване на ароматни съединения може да се илюстрира с помощта на бензен като пример:
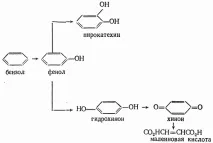
Халогениране и други реакции на заместване могат също да се извършват на анода. В индустриален мащаб този метод се използва за получаване на йодоформ от етанол и KI. Процесът протича при потенциала на системата, така че първият етап изглежда е освобождаването на аниона G. Установено е, че хипойодитният йон участва в последващата реакция и следователно процесът се провежда в леко алкална среда при контролирано рН. Чистият йодоформ се утаява от воден разтвор с добър добив. Анодното халогениране е много удобно за извършване на процеса на флуориране, тъй като не изисква елементарен флуор.
Вижте също [2, 18]; Специализирани периодични доклади, Електрохимия, 2 (1972).