ФИЗИЧНИ И ХИМИЧНИ СВОЙСТВА НА АЛУМИНИЯ
Алуминият е сребристобял метал с висока електрическа и топлопроводимост. (Топлопроводимостта на алуминия е 1,8 пъти по-голяма от тази на медта и 9 пъти по-голяма от тази на неръждаемата стомана.) Той има ниска плътност - приблизително три пъти по-малка от тази на желязото, медта и цинка. И въпреки това е много издръжлив метал.
Три електрона от външната обвивка на алуминиев атом са делокализирани по кристалната решетка на металния алуминий. Тази решетка има лицево-центрирана кубична структура, подобна на тази на калай и злато (вижте раздел 3.2). Следователно алуминият има добра пластичност.
Химични свойства
Алуминият образува съединения от йонен и ковалентен тип. Характеризира се с висока йонизационна енергия (Таблица 15.1). Плътността на заряда (съотношението на заряд към радиус) за йон е много висока в сравнение с катиони на други метали от същия период (виж таблица 15.2).
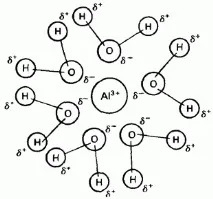
Ориз. 15.2. Хидратиран алуминиев йон.
Таблица 15.2. Съотношение на заряд към радиус на катиони

Тъй като йонът има висока плътност на заряда, той има голяма поляризационна сила. Това обяснява защо изолираният йон се намира само в много малко съединения, например в безводен алуминиев флуорид и алуминиев оксид, и дори тези съединения показват забележим ковалентен характер. Във воден разтвор йонът поляризира водните молекули, които в резултат на това хидратират катиона (виж фиг. 15.2). Тази хидратация се характеризира с висока екзотермичност:
Стандартният редокс потенциал на алуминия е - 1,66 V:
Следователно в електрохимичната серия от елементи алуминият е разположен доста високо (вижте раздел 10.5). Това предполага, че алуминият трябва лесно да реагирас кислород и разредени минерални киселини. Въпреки това, когато алуминият реагира с кислорода, на повърхността му се образува тънък, непорест оксиден слой. Този слой предпазва алуминия от по-нататъшно взаимодействие с околната среда. Оксидният слой може да се отстрани от алуминиевата повърхност, като се натрие с живак. След това алуминият може да се свързва директно с кислород и други неметали, като сяра и азот. Взаимодействието с кислород води до реакцията
Анодиране. Алуминият и леките алуминиеви сплави могат да бъдат допълнително защитени чрез удебеляване на естествения оксиден слой чрез процес, наречен анодизиране. При този процес алуминиев предмет се поставя като анод в електролитна клетка, където като електролит се използва или хромна киселина, или сярна киселина.
Алуминият реагира с гореща разредена солна и сярна киселина, за да образува водород:
Първоначално тази реакция протича бавно поради наличието на оксиден слой. Въпреки това, когато се отстрани, реакцията става по-интензивна.
Концентрираната и разредената азотна киселина, както и концентрираната сярна киселина правят алуминия пасивен. Това означава, че не реагира с посочените киселини. Такава пасивност се обяснява с образуването на тънък оксиден слой върху алуминиевата повърхност.
Разтвори на натриев хидроксид и други алкали взаимодействат с алуминий, образувайки тетрахидроксоалуминатни (III) йони и водород:
Ако оксидният слой се отстрани от повърхността, алуминият може да действа като редуциращ агент в редокс реакциите (вижте раздел 10.2). Той измества металите под него в електрохимичната серия от техните разтвори. Например
визуаленпример за редукционната способност на алуминия е алуминотермичната реакция. Това е името, дадено на реакцията между алуминий на прах и
оксид В лабораторията обикновено се инициира с помощта на магнезиева лента като предпазител. Тази реакция протича много бързо и при нея се отделя такова количество енергия, което е достатъчно, за да се стопи полученото желязо:
Алуминотермичната реакция се използва за извършване на алуминотермично заваряване; например релсите са свързани по този начин.
Алуминиев оксид Алуминиевият оксид или алуминиевият оксид, както често се нарича, е съединение, което има както йонни, така и ковалентни свойства. Има точка на топене и в разтопено състояние е електролит. Поради тази причина често се смята за йонно съединение. В твърдо състояние обаче алуминиевият оксид има скелетна кристална структура.
Корунд. Безводните форми на алуминиевия оксид образуват минерали от корундовата група при естествени условия. Корундът е много твърда кристална форма на алуминиев оксид. Използва се като абразивен материал, тъй като по твърдост отстъпва само на диаманта. Големите и прозрачни, често оцветени кристали корунд се оценяват като скъпоценни камъни. Чистият корунд е безцветен, но наличието в него на малко количество примеси от метални оксиди придава на скъпоценния корунд характерен цвят. Например, цветът на рубина се дължи на наличието на йони в корунда, а цветът на сапфирите се дължи на наличието на кобалтови йони.Виолетовият цвят на аметиста се дължи на наличието на примес от манган в него. Чрез сливане на алуминиев оксид с оксиди на различни метали могат да се получат изкуствени скъпоценни камъни (виж също таблици 14.6 и 14.7).
Алуминиевият оксид е неразтворим във вода и има амфотерностсвойства, реагира както с разредени киселини, така и с разредени основи. Реакцията с киселини се описва с общото уравнение:
Реакцията с алкали води до образуването на -йон:
алуминиеви халогениди. Структурата и химическото свързване в алуминиевите халиди са описани в раздел. 16.2.
Алуминиевият хлорид може да се получи чрез преминаване на сух хлор или сух хлороводород върху нагрят алуминий. Например
С изключение на алуминиевия флуорид, всички други алуминиеви халиди се хидролизират с вода:
Поради тази причина алуминиевите халогениди "пушат" при контакт с влажен въздух.
алуминиеви йони. Вече посочихме по-горе, че йонът е хидратиран във вода. Когато алуминиевите соли се разтварят във вода, се установява следното равновесие:
В тази реакция водата действа като основа, тъй като приема протон, а хидратираният алуминиев йон действа като киселина, тъй като отдава протон. Поради тази причина алуминиевите соли са киселинни. Ако в
Таблица 15.3. Най-често срещаната стипца

разтвор на малко алуминиева сол добавете алкали, например, или се получава утаяване на хидратиран алуминиев триоксид:
Въпреки това, добавянето на излишно количество алкали води до разтваряне на тази утайка поради образуването на разтворим анион:
В тази реакция хидратираният алуминиев хидроксид действа като киселина. Той обаче реагира и с киселини:
По този начин алуминиевият хидроксид има амфотерни свойства.
алуминиев сулфат и стипца. Стипците са двойни соли с обща формула. В тази формула еднократно зареден йон, например, или трикратно зареден йон. например или. В табл.15.3 показва имената и формулите на някои от най-често срещаните стипци.
Когато стипцата се разтвори, те образуват прости йони. Например калиевата стипца образува йони в разтвор Кристалите на стипцата имат октаедрична структура.
Морилки. Калиевата стипца и алуминиевият сулфат се използват като щипки в процеса на боядисване на текстил. За тази цел тъканта се накисва в разтвор на калиева стипца или алуминиев сулфат и след това към разтвора се добавя малко алкали. Солният разтвор действа като слаба киселина и образува алуминиев хидроксид (виж по-горе). Алуминиевият хидроксид се отлага върху нишките на тъканта и "разяжда" тъканта. Освен това той абсорбира багрилото и по този начин го свързва с тъканта. Морилките са получили името си от термина "ецват" (корозират).