Геометрична изомерия Wikipedia


Цис-транс-изомерията[1] [2] [3] илигеометричната изомерияе един от видовете стереоизомерия: тя се състои във възможността заместителите да бъдат разположени от едната или от противоположните страни на равнината на двойна връзка или неароматен пръстен. Всички геометрични изомери са диастереомери, защото не са огледални изображения един на друг.Цис- итранс-изомерите се срещат както сред органичните съединения, така и сред неорганичните. Понятиятаcisиtransне се използват в случая на конформери, две геометрични форми, които лесно се сливат една в друга, вместо това се използват обозначенията „syn“ и „anti“.
Обозначенията “cis” и “trans” произлизат от латински, в превод от този езикcisозначава “от едната страна” [4], аtransозначава “от другата страна” или “срещу”. Терминът "геометрична изомерия" според IUPAC се счита за остарял синоним нацис-транс-изомерия [5] .
Трябва да се помни, че номенклатуратацис-трансописваотносителнотоподреждане на заместителите и не трябва да се бърка с номенклатуратаE,Z, която даваабсолютностереохимично описание и се прилага само за алкени.
Съдържание
Органична химия
Ако заместителите на диастереомера са разположени от едната страна на двойната връзка, такъв изомер се означава катоцис-, ако те са разположени от противоположните страни на равнината на двойната връзка, тогава това етранс-изомерът. Пример е малкият въглеводород 2-бутен.
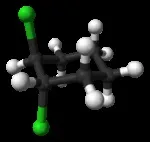
Цис-транс-изомерията също е показана от алициклични съединения, в които заместителите могат да бъдат разположени от едната или от противоположните страни на равнината на пръстена. Пример е1,2-дихлорциклохексан:
Разлика във физичните свойства
Цис- итранс-изомерите обикновено се различават по своите физични свойства. Тези разлики са резултат от разликата във формата на молекулата, разликата в разстоянието между заместителите и функционалните групи, а също и от разликата в общия диполен момент.
Разликите могат да бъдат незначителни, както в случая на точката на кипене на алкени с права верига, като 2-пентен, чийтоцисизомер кипи при 37°C, атрансизомерът при 36°C [6] . Разликата междуцис- итранс- става още по-голяма, ако в молекулата има поляризирани връзки, както в 1,2-дихлоретилена.Цис-изомерът в този случай кипи при 60,3 °C, нотранс-изомерът кипи при 47,5 °C [7] . В случая на изомераcis, ефектите на две полярни C-Cl връзки се сумират, образувайки силен молекулярен дипол, който поражда силни междумолекулни взаимодействия (сили на Keesom), които добавят към дисперсионните сили и водят до повишаване на точката на кипене. Втрансизомера, напротив, това не се случва, тъй като два момента на C–Cl връзките са разположени един срещу друг и се компенсират взаимно, без да създават допълнителен диполен момент (въпреки че техният квадруполен момент изобщо не е нула).
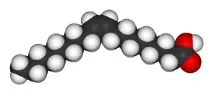
Двата геометрични изомера на бутендиовата киселина са толкова различни по своите свойства и реактивност, че дори получават различни имена:цис-изомерът се нарича малеинова киселина, атранс-изомерът се нарича фумарова киселина. Ключовото свойство, което определя относителната точка на кипене, е полярността на молекулата, тъй като засилва междумолекулните взаимодействия, като по този начин повишава точката на кипене. По същия начин симетрията определя температурата.топене, тъй като симетричните молекули се пакетират по-добре в твърдо състояние, дори ако полярността на молекулата не се променя. Един пример за такава зависимост са олеиновата и елаидовата киселини; олеиновата киселина,цисизомерът, има точка на топене 13,4°C и се превръща в течност при стайна температура, докатотрансизомерът, елаидиновата киселина, има по-висока точка на топене от 43°C, тъй като по-директнияттрансизомер има по-плътно опаковане и остава твърд при стайна температура.
Такатранс-изомерите, тъй като са по-малко полярни и по-симетрични, имат по-ниски точки на кипене и по-високи точки на топене, ацис-изомерите, които обикновено са по-полярни и по-малко симетрични, имат по-високи точки на кипене и по-ниски точки на топене, по-добре са разтворими във вода или инертни разтворители и също така често имат по-висока топлина на изгаряне, което е свързано с тяхната по-ниска стабилност [8] .
Цис-транс-изомерите на дикарбоксилните киселини също се различават по киселинност: малеиновата киселина (цис) е много по-силна киселина от фумаровата киселина (транс). По този начин, първата константа на дисоциация за фумарова киселинаpKa1= 3.03, и за малеинова киселинаpKa1= 1.9. Напротив, константата на дисоциация на втората карбоксилна група за фумарова киселина е по-голяма отколкото за малеинова киселина, а именно:pKa2= 4,44 за фумарова киселина иpKa2= 6,07 за малеинова киселина. Поради пространствената близост на карбоксилните групи вцис-формата, тенденцията на водорода да се йонизира се увеличава, така че първата константа на малеиновата киселина е по-голяма. За втория протон обаче е по-трудно да преодолее привличането на два близкикарбоксилни групи вцис-изомера, така че втората константа на дисоциация на малеиновата киселина е по-малка от тази на фумаровата киселина [9] . Подобен принцип се прилага за алицикличните дикарбоксилни киселини, но с увеличаване на размера на пръстена трябва да се вземе предвид и влиянието на неравнинната форма на пръстена [10] .
Вициналната ядрена спин-спинова константа на свързване (3JHH), измерена чрез ЯМР спектроскопия, е по-голяма затрансизомерите (диапазон: 12–18 Hz; средно: 15 Hz), отколкото зацисизомерите (диапазон: 0–12 Hz; средно: 8 Hz) [11] .
Стабилност
Като правило, за ациклични системитранс-изомерът е по-стабилен отцис. Причината за това обикновено е да се засилят нежеланите пространствени взаимодействия на близко разположени заместители вцисизомера. По същата причина специфичната топлина на изгаряне натранс-изомерите е по-ниска от тази нацис, което показва по-голяма термодинамична стабилност [8] . Изключения от това правило са 1,2-дифлуоретилен, 1,2-дифлуородиазен (FN=NF), 1-бромопропен-1 и няколко други халоген- и кислород-заместени етилени. В този случайцис-изомерът е по-стабилен оттранс-изомерът, тъй като между такива заместители не преобладават сили на отблъскване, а сили на привличане (като силите на Лондон). В допълнение, поради относително малкия обем на заместителите, не възниква пространствено препятствие [12] [13] . От 1,2-дихалогеноетилените, само транс-изомерът на 1,2-дийодоетилен е по-стабилен отцис-изомера, тъй като поради големия радиус йодните атоми изпитват силно пространствено взаимодействие, ако са от една и съща страна на двойната връзка [14] .
Взаимно превръщане на изомери
Геометрични изомери, чиято разлика е свързана с позициятазаместители около двойната връзка се различават от стереоизомерни форми от различен тип - конформери. Отделното съществуване нацис- итранс-изомери по същество е възможно само поради високата енергийна бариера на въртене около двойната връзка, което прави възможно отделното съществуване нацис- итранс-изомери, докато конформерите съществуват само под формата на равновесна смес. Стойността на бариерата за въртене около двойната връзка в простите алкени е 250–270 kJ/mol. Въпреки това, ако от едната страна се поставят силни донори на електрони (-SR), а от другата се поставят групи, силни акцептори на електрони (-CN, -COC6H5), като по този начин се поляризира двойната връзка, това ще доведе до значително намаляване на ротационната бариера. Бариерата за въртене около така поляризирана връзка може да бъде намалена до 60–100 kJ/mol. Ниски енергийни бариери, когато енергийната разлика междуцис-транс-изомерите и конформерите е изгладена, са открити за аминови производни на ацетооцетен естер и енаминокетони. Показано е, че равновесното положение в такива системи зависи от природата на разтворителя. Така в неполярни разтворители енаминокетоните съществуват 100% вcis-форма, стабилизирана от вътрешна водородна връзка, докато до 50% отtrans-форма се появява в полярни разтворители [15] .
E,Z-номенклатура

Означениетоцис-трансе добре приложимо само за именуване на изомерни алкени с два различни вида заместители при двойната връзка, в сложни молекули такава номенклатура става твърде неясна. В тези случаи се използва разработената нотация IUPACE,Z, която уникално дефинира името на съединенията за всички възможни случаи и следователно е особено полезна за наименуванетри- и тетра-заместени алкени. Тази система избягва объркване относно това кои групи трябва да се считат зацис- илитранс- във връзка една с друга.
Ако двете по-стари групи са разположени от една и съща страна на двойната връзка, тоест те са вцис-позиция една към друга, тогава такова вещество се наричаZ-изомер (от немски zusammen - заедно). Когато по-старите групи са разположени от противоположните страни на двойната връзка (втранс-ориентация), тогава такъв изомер се наричаE-изомер (от немски entgegen - срещуположно). Редът на приоритет на групите и атомите се определя от правилата на Кан-Инголд-Прелог. За всеки от двата атома в двойната връзка е необходимо да се определи старшинството на всеки заместител. Ако и двата старши заместителя са разположени от една и съща страна на равнината на π-връзката, тогава такава конфигурация се обозначава със символаZ, ако тези групи са разположени от противоположните страни на равнината на π-връзката, тогава конфигурацията се обозначава със символаE[3] .
Трябва да се отбележи, чецис/трансиE,Z-номенклатурите се основават на сравнението на различни заместители на алкените, така чеZ-изомерът не винаги съответства нацис-изомера, аE-изомерът натранс-изомера. Напримертранс-2-хлорбутен-2 (двете метилови групи С1 и С4, на гръбнака на бутен-2а са втрансориентация) е (Z)-2-хлорбутен-2 (хлорът е по-стар от метила, който от своя страна е по-стар от водорода, така че хлорът и С4-метилът се считат за разположени заедно).
В неорганичната химия
Цис–транс-изомерия също се среща в неорганични съединения, главно в диазени и комплексни съединения.
Диазените (и свързаните с тях дифосфени) проявяватцис-транс-изомерия. Както в случая с органичнитесъединения,цис-изомерът е по-реактивен, само той е в състояние да редуцира алкени и алкини до алкани.Транс-изомерът, приближавайки се до алкена, не може да подреди своите водородни атоми, за да редуцира ефективно алкена, ацис-изомерът успешно се справя с тази задача поради подходящата форма.