Хидролиза на соли
Химическото обменно взаимодействие на разтворени солеви йони със съставните части на водата, което води до образуването на слабо дисоцииращи продукти (киселини, основи, киселинни аниони, основни катиони) и придружено от промяна на рН на средата, се нарича солева хидролиза. От определението следва, че не всички соли се подлагат на хидролиза: ако няма връзка между йоните на солта и съставните части на водата, това означава липса на хидролиза.
На практика има обратна реакция - неутрализация, с образуване на слаб електролит H2O.
Това е сходството на хидролизата с други обменни реакции на електролити - киселини, основи, соли. Разликите в реакциите на соли с вода от техните реакции с киселини и основи са свързани с електролитните свойства на водата. Като киселини, водата образува H +-йони по време на дисоциация, като алкали - OH - йони, но и двете присъстват в чиста вода в много малки концентрации (10 -7 mol / l). Следователно хидролизата на солните йони протича, първо,обратимо,с изключение на отделни случаи, и второ, за многозарядните йони -стъпаловидно.
В съответствие с явленията, които възникват при разтваряне на сол във вода, логично е да се следва следната последователност при съставянето на уравнения за хидролиза:
1 . Използвайки справочни таблици, определете естеството на солта:
а) разберете разтворимостта; неразтворимите и трудноразтворимите соли не се хидролизират;
б) инсталирайтекакви основни катиони и какви киселинни аниони образуват солта; само йони на слаби електролити влизат в химична реакция с вода, йони на силни електролити не се хидролизират.
2. За разтворима сол, съдържаща слаби електролитни йони, напишете уравнението на електролитна дисоциация.
3. Съставете съкратено йонно-молекулно уравнение за хидролизата на слаб електролитен йон с една водна молекула.
4. Добавете противойони в количества, които осигуряват електронеутралността на получените частици.
5. Напишете уравнение на молекулярна хидролиза.
6. Посочете характера на хидролизата и средата на разтвора: хидролизата може да бъде частична или пълна, обратима или необратима, стъпаловидна; средата на разтвора е кисела, алкална или неутрална.
Известни са три типични случая:
1 . Солите, образувани от слаба основа и силна киселина, се хидролизират от катион, който свързва ОН - - водни йони; водородните йони H + се натрупват в разтвора и разтворът става кисел, рН
2. Солите, образувани от силна основа и слаба киселина, се хидролизират от анион, който свързва Н + -йони на водата; OH - йони се натрупват в разтвора, създавайки алкална среда, pH> 7.
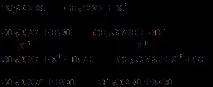
Характер на хидролизата: частична, обратима.
3. Солите, образувани от слаба основа и слаба киселина, се хидролизират от катиона и от аниона

Kdiss, (HSO3 -) = 6,3 × 10 -8 -5
Анион SO3 2- - хидролизира по-силно, H + - йони се свързват повече от OH - -
йони. Средата на разтвора е слабо алкална.
Естеството на хидролизата: пълна, обратима, стъпаловидна.
Най-силно се хидролизират солите от третия тип. Ако киселината и основата, които образуват солта, са не само слаби електролити, но и умерено разтворими,или нестабилни и се разлагат с образуването на летливи продукти, след което настъпва пълна, необратима хидролиза:
2Cr 3+ + 3SO4 2- + 6Na + + 3S 2- + 6HOH ® 2Cr(OH)3¯ + 3H2S + 6Na + + 3SO4 2-
2Cr 3+ + 3S 2- + 6HOH ® 2Cr(OH)3¯ + 3H2S
Съвместното присъствие на Cr 3+ и S 2- йони засилва тяхната хидролиза, в резултат на което се образуват хромен хидроксид и сероводород вместо хромов сулфид, което лесно може да се докаже експериментално.
Количествено хидролизата се характеризира със степента на хидролиза (h) и хидролизната константа (Kg). Степента на хидролиза е съотношението на концентрацията на сол, която е претърпяла хидролиза (Cr) към общата концентрация на сол в разтвора (Co)
(1 или 2)
За анионна хидролизираща сол:
където [HOH] » Co = const, тъй като за хидролизата на солта се изразходва незначително количество вода.
(3)
(4)
За сол, която се хидролизира при катиона:
(5)
(6)
Kw е йонният продукт на водата,
Kdiss.electrolyte - константа на дисоциация на хидролизния продукт (слаба киселина или киселинен анион, слаба основа или основен катион). Константата и степента на хидролиза са свързани с уравнение, подобно на закона за разреждане на Оствалд за дисоциацията на слаб електролит:
(7)
Най-често h « l, след това KG \u003d CO × h 2 (8)
(9)
Комбинирайки изрази (6) и (9), получаваме:
(10)
От последния израз следва, че степента на хидролиза е по-голяма от:
1) концентрацията на сол (Co) е по-ниска, т.е. колкото по-разреден е разтворът;
2) по-малко Kdiss. електролит, т.е. колкото по-слаба е киселината или основата, която образува солта;
Числените стойности на константите на дисоциация на киселинни аниони и основни катиони са много по-малки от константите на дисоциация на киселини и основи, съответно, така че хидролизатапреминава главно на 1-ви етап:
= » 100
Хидролизата на CO3 2-аниона в първия етап надвишава хидролизата във втория етап с около 100 пъти.
3) повече Kw; Йонният продукт на водата се увеличава при нагряване, тъй като дисоциацията на водата е ендотермичен процес. Хидролизата се засилва чрез нагряване.
За соли, хидролизирани от катион и анион, връзката между константата и степента на хидролиза се изразява с уравнението:
(единадесет)
Изчисляването на концентрациите на Н + - и ОН - йони във водни разтвори на хидролизируеми соли, като се вземе предвид степента на хидролиза, се извършва в съответствие с уравненията:
[H + ]=CKt,g=Cсол, g=Co×h=Co× (12)
За анионна хидролизираща сол:
[OH - ]= (13)
Тъй като двойно и трикратно заредените йони се хидролизират в по-голяма степен от първия етап, при изчисленията на [H + ] и [OH - ] трябва да се вземат стойностите на константите на дисоциация на киселинни аниони и основни катиони.
Не намерихте това, което търсихте? Използвайте търсачката:
Деактивирайте adBlock! и опреснете страницата (F5)наистина е необходимо