Изомерия – Уикипедия.
Изомерия(от старогръцки ἴσος - равен + μέρος - дял, част) - явление, състоящо се в съществуването на химични съединения -изомери- еднакви по атомен състав и молекулно тегло, но различни по структура или разположение на атомите в пространството и, като резултат, по свойства.
Съдържание
Историческа информация
В резултат на дискусията между J. Liebig и F. Wöhler през 1823 г. е установено, че има две вещества от състава на AgCNO, които са рязко различни по свойства - цианат (AgNCO (англ.) български) и експлозивно (AgONC) сребро. Друг пример са винената и винената киселина, след изследването на които J. Berzelius въвежда термина "изомерия" през 1830 г. и предполага, че разликите възникват поради "различно разпределение на прости атоми в сложен атом" (т.е., в съвременни термини, молекула).
Истинското обяснение на изомерията е получено едва през 2-рата половина на 19 век въз основа на теорията за химическата структура на А. М. Бутлеров (структурна изомерия) и стереохимичните учения на Й. Г. Ван Хоф (пространствена изомерия).
Структурна изомерия
Структурната изомерия е резултат от разликите в химичната структура. Този тип включва:
Изомерия на въглеродната верига (въглероден скелет)
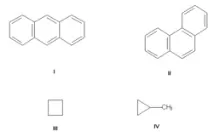
Изомерия на въглеродния скелет, дължаща се на различния ред на свързване на въглеродните атоми. Най-простият пример е бутан CH3-CH2-CH2-CH3 и изобутан (CH3)3CH. Други примери: антрацен и фенантрен (съответно формули I и II), циклобутан и метилциклопропан (III и IV).
Валентна изомерия
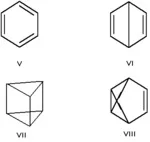
Валентната изомерия е специален вид структурна изомерия, при която изомерите могат да се превръщат един в друг само поради преразпределението на връзките. Например валентните изомери на бензен(V) сабицикло[2.2.0]хекса-2,5-диен (VI, "бензен на Дюар"), призман (VII, "бензен на Ладенбург"), бензвален (VIII).
Изомерия на функционалната група (междукласова изомерия)
Различава се по характера на функционалната група; например етанол (CH3-CH2-OH) и диметилов етер (CH3-O-CH3).
позиционна изомерия
Вид структурна изомерия, характеризираща се с разлика в позицията на едни и същи функционални групи или множество връзки с един и същ въглероден скелет. Пример: 2-хлоробутанова киселина и 4-хлоробутанова киселина.
Метамерията е вид структурна изомерия, която се характеризира с различно разпределение на въглеродните атоми между няколко въглеводородни радикала, разделени в една молекула от хетероатом. Метамерията е известна в серията алифатни етери, естери, тиоалкохоли и амини. Сега терминът се използва рядко.
А. М. Бутлеров също посочи този тип изомерия, наричайки я „изомерия на нетвърди структури“.
Пространствена изомерия (стереоизомерия)
Пространствената изомерия (стереоизомерия) възниква в резултат на разликите в пространствената конфигурация на молекули, които имат еднаква химична структура. За обозначаване на пространствени изомери от различни типове е разработена стереохимична номенклатура, събрана в раздел E на номенклатурните правила на IUPAC за химия [източникът не е посочен 3026 дни] .
Този тип изомерия се подразделя наенантиомеризъм(оптичен изомеризъм) идиастереомеризъм.
Енантиомеризъм (оптичен изомеризъм)
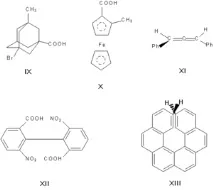
Енантиомерите (оптични изомери, огледални изомери) са двойки оптични антиподи - вещества, характеризиращи се с противоположни по знак и еднакви по големина завъртания на равнината на поляризация на светлината, с идентичност на всичкидруги физични и химични свойства (с изключение на реакции с други оптически активни вещества и физични свойства в хирална среда). Необходимо и достатъчно основание за появата на оптични антиподи е принадлежността на молекулата към една от следните точкови групи на симетрия: Cn, Dn, T, O или I (хиралност). Най-често говорим за асиметричен въглероден атом, тоест атом, свързан с четири различни заместителя.
Други атоми също могат да бъдат асиметрични, като силиций, азот, фосфор и сяра. Наличието на асиметричен атом не е единствената причина за енантиомерите. И така, производните на адамантан (IX), фероцен (X), 1,3-дифенилалален (XI), 6,6'-динитро-2,2'-дифенова киселина (XII) имат оптични антиподи. Причината за оптичната активност на последното съединение еатропизомерията, т.е. пространствената изомерия, причинена от липсата на ротация около единична връзка. Енантиомерията се проявява и в спираловидни конформации на протеини, нуклеинови киселини, в хексахелицен (XIII).
диастереомеризъм
Всяка комбинация от пространствени изомери, които не образуват двойка оптични антиподи, се счита за диастереомерна. Има σ- и π-диастереомери.
σ—диастереомерия
σ-диастереомерите се различават един от друг по конфигурацията на някои от хиралните елементи, които съдържат. И така, диастереомерите са (+)-винена киселина и мезо-винена киселина, D-глюкоза и D-маноза, например:
π—диастереомерия (геометрична изомерия)
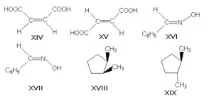
π-диастереомерите, наричани още геометрични изомери, се различават един от друг по различното пространствено разположение на заместителите спрямо равнината на двойната връзка (най-често C=C и C=N) или пръстена. Те включват, например, малеинова и фумарова киселина (формули XIV иXV, съответно), (E)- и (Z)-бензалдоксими (XVI и XVII), цис- и транс-1,2-диметилциклопентани (XVIII и XIX).
Изомеризация
Химичните трансформации, в резултат на които структурните изомери се превръщат един в друг, се наричат изомеризация. Такива процеси са важни в индустрията. Така например, изомеризацията на нормални алкани в изоалкани се извършва за увеличаване на октановото число на моторните горива; пентан, изомеризиран до изопентан за последващо дехидрогениране до изопрен. Вътремолекулните пренареждания също са изомеризации, от които например голямо значение има пренареждането на Бекман - превръщането на циклохексаноноксима в капролактам (суровина за производството на капрон).
Процесът на взаимно преобразуване на енантиомери се наричарацемизация: той води до изчезване на оптичната активност в резултат на образуването на еквимоларна смес от (−)- и (+)-форми, т.е. рацемат. Взаимното превръщане на диастереомерите води до образуването на смес, в която преобладава термодинамично по-стабилната форма. В случая на π-диастереомери това обикновено е транс формата. Взаимното превръщане на конформационни изомери се нарича конформационно равновесие.
Феноменът на изомерията значително допринася за нарастването на броя на известните (и в още по-голяма степен на броя на потенциално възможните) съединения. По този начин възможният брой структурни изомерни децилови алкохоли е повече от 500 (от които са известни около 70), има повече от 1500 пространствени изомери.
При теоретичното разглеждане на проблемите на изомерията все по-широко разпространение получават топологичните методи; изведени са математически формули за изчисляване на броя на изомерите.