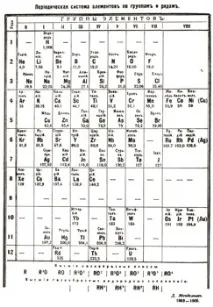
Как радиоактивните елементи намериха своето място в периодичната таблица
ГЛАВНО МЕНЮ
ОСНОВНО УЧИЛИЩЕ
български език
ЛИТЕРАТУРА
АНГЛИЙСКИ ЕЗИК
НЕМСКИ
МАТЕМАТИКА
ИНФОРМАТИКА
Как радиоактивните елементи намериха своето място в периодичната таблица
Развитието на науката постави периодичния закон пред ново, още по-тежко изпитание от тези, от които той вече премина с чест.
Беше в края на миналия - началото на нашия век. Във Франция двама скромни учени - съпрузите Пиер и Мария Кюри - се заинтересуваха от странен феномен, открит от друг френски учен Бекерел. Те решиха да разберат защо минералите и рудите, съдържащи уран, излъчват мистериозни невидими лъчи, които могат да проникнат през непрозрачни тела и да действат върху фотографска плака. Много скоро те откриха, че в природата има минерали, в които има малко уран, и тези минерали действат върху плочата много по-силно от чистия уран. Семейство Кюри предприемат усърдно търсене, което отнема много години от живота им на нови неизвестни елементи - носители на радиоактивно лъчение (вижте статията "Раждането, живота и смъртта на химическите елементи").
Първи е открит полоний, последван от радий. Това бяха нови елементи, науката още не ги познаваше. Радиоактивността на тези елементи е била хиляди пъти по-силна от тази на урана. Чудотворните свойства рязко ги отличават от всички известни досега елементи.
Съвсем бързо, веднага след като бяха изследвани химичните свойства на новите елементи, те намериха своето място в периодичната таблица. Оказа се, че и двата елемента - и полоний, и радий - също някога са били предсказани от Менделеев. Радий - това беше екабариум, той взе 88-та клетка в периодичната система, полоний - 84-та. Менделеев го нарича екателурий. Така че имаше място за тях иизглеждаше, че всичко върви добре. Но когато свойствата на новите радиоактивни елементи бяха изследвани в детайли, бяха открити напълно неочаквани за науката явления.
Най-важното беше, че с откриването на радиоактивните елементи се сринаха обичайните и привидно непоклатими представи за вечността и неизменността на всеки елемент. Новите елементи бяха непостоянни, те се раждаха и изчезваха, превръщайки се в други елементи. Някои от тях изчезнаха за милионни от секундата, други живяха хиляди години. Свойството им да излъчват невидими лъчи свидетелства за разпадането на атомите.
Установено е, че радият е далечен потомък на урана. Самият радий се превръща в радиоактивен газ радон. И при всяка трансформация радиоактивен атом задължително излъчва или заредени ядра на хелиеви атоми (а-частици) или електрони на бета-частица). Физиците скоро откриха повече от тридесет радиоактивни елемента. Колко потомци се оказаха уран, можете да изчислите сами (вижте в статията "Раждане, живот и смърт на химически елементи" Фиг. 4 и 5). Не по-малко потомци са открити и в елемента торий, който също се оказа радиоактивен. И почти същия брой - в редица морски анемонии. Науката отново се изправи пред труден и фундаментално важен въпрос: къде и как да намерят места в периодичната система за всички тези нови многобройни елементи? Те бяха много повече от свободните клетки в таблицата. Науката трябваше да реши този проблем без участието на Менделеев. Той не доживя да види последното, най-трудно изпитание на великата си идея.
Химиците започнаха да определят химичните свойства на нови радиоактивни елементи. Беше трудна задача. В края на краищата сред тези елементи имаше такива, които "живееха" за незначителна част от секундата. Отговорът беше открит, когато радиоактивните елементи бяха толкова проучени, че стана възможно да се сравняватприродата на лъчите, излъчвани от елемента, с неговата химическа природа и с природата на новия елемент, който се образува от него по време на радиоактивна трансформация. Но всичко това беше възможно да се разгадае отново с помощта на периодичната система на Менделеев.
Изучавайки свойствата на уран-X1, най-близкият потомък на урана, неговият „син“, химиците скоро се убедиха, че неговите химични свойства са неразличими от отдавна познатия торий. Но все пак не беше торий, познат на химиците. Торият е често срещан елемент, неговата радиоактивност е толкова слаба, че е трудно да се открие. А уран-X1 е силно радиоактивен, бързо се разпада, след 24 дни от него остава само половината от количеството, което е било преди. Като цяло това е нов елемент. Но все пак химически това е торий. Ако уран-X1 се смеси с торий, никаква химическа реакция не може да ги раздели.
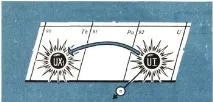
Уран се превръща в уран-Х1, излъчвайки a-лъчи (фиг. 1). За всеки атом на уран, който се разпада, a-частица излита от ядрото си и отнася два положителни заряда. Уран е 92-ри в таблицата, в седмия период. И къде трябва да бъде първият му потомък, уран-Xi? Менделеев поставя торий в 90-та клетка на своята система. А уран-Xi е неразличим от тория. След дълго и трудно търсене и колебание се наложи да се признае, че мястото на уран-Х1 е в клетката, където се намира торият; А-частицата отнася два положителни заряда от ядрото на атома и в този случай се образува нов атом, който заема място в периодичната система с две единици по-малко число.
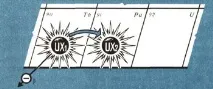
Нека сега проследим какво се случва след това с уран-X1 по време на разпада му (фиг. 2). Той претърпява бета-трансформация, образувайки ново радиоактивно вещество, което беше обозначено като уран-Х2, изчезвайки още по-бързо. Оказа се, че химичните свойства на уран-Х2 трябва да бъдат поставени в 91-ва клетка.
Но загубата на единотрицателният заряд от ядрото на атома е еквивалентен на придобиването на един положителен заряд. В резултат на това се оказа, че с увеличаване на положителния заряд на ядрото на елемент с единица се образува нов елемент, заемащ клетка в периодичната система, чийто брой е по-голям с единица. На свой ред, уран-Х2 отново губи бета частица (фиг. 3) и се превръща в уран-II, който е напълно неразличим от своя "прадядо" - обикновения уран и трябва да бъде поставен в една клетка с него, т.е. да заеме 92-ро място в таблицата. И винаги увеличаването на положителния заряд на единица в ядрото (загубата на един отрицателен електрон) води до такава промяна в химичните свойства, която съответства на увеличаване на поредния номер на елемента с единица.
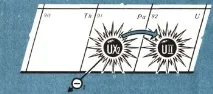
Този закон, който управлява пътуването на атомното ядро по периодичната таблица по време на радиоактивен разпад, е получил в науката името правило за изместване. Изучавайки радиоактивните елементи, химиците се натъкват на нов, невъзможен и немислим факт от гледна точка на старата химия. Вижте сами какво се случи. Атомното тегло на урана е 238. Всеки негов атом по пътя на радиоактивното преобразуване в уран-II губи последователно една а-частица (т.е. ядрото на хелиев атом, чието атомно тегло е 4) и две бета-частици (това са леки електрони с незначителна маса). В резултат на това ядреният заряд на радиоактивния атом на уран-II се оказва същият като този на обикновения уран. И по своите химични свойства е неразличим от обикновения уран.
Но атомното тегло, разбира се, става напълно различно. Всяка изхвърлена а-частица намалява атомното тегло с четири единици, а по време на бета трансформациите то остава същото. Промяна в атомното тегло на урана:
В същата клетка, където, както смята Менделеев, трябва да има само един елемент със собствено атомно тегло, присъщо само на него,сега имаше две различни вещества, с различни физически характеристики и най-важното, макар и с различни атомни тегла, но с еднакви химични свойства. Оказа се, че един и същи елемент може да има различно атомно тегло.
Но това не е достатъчно. Получава се още по-изненадващ резултат: по време на 3-разпад атомното тегло не се променя, но химическата природа на елемента се променя много рязко. Уран-X1 е химически торий, а уран-X2 е химически неразличим от елемента протактиний (Ra); следователно различни елементи могат да имат еднакво атомно тегло.
Какво стана накрая? Менделеев приема атомното тегло като основен атрибут на елемент. Но в поредицата от радиоактивно разпадане на уран, крайният продукт е радий-G, неговото атомно тегло е 206. Този елемент вече е неактивен и химически неразличим от оловото.
При разпадането на тория в крайна сметка се образува и неактивен торий-D, атомното му тегло е 208. По химични свойства това също е олово. Сериите на разпадане на актиний завършват с неактивен продукт - актиний-D, атомното му тегло е 207 и химически отново е олово.
Но не само това, в тези серии има и радиоактивни междинни продукти на разпадане: радий-B с атомно тегло 214, радий-D с атомно тегло 210, торий-B, чието атомно тегло е 212, и актиний-B с атомно тегло 211. И всички тези радиоактивни елементи, един до един, са абсолютно подобни на оловото и всички имат различно атомно тегло.
Но в крайна сметка във всяка клетка може да има само един елемент със собствено атомно тегло! Клетка 82 може да съдържа олово с атомно тегло 207,19. Изследвайки радиоактивните елементи, учените откриха още седем вещества с атомни тегла 214, 212, 211, 210, 208, 207, 206 и химичните свойства на оловото. Науката се оказа в много голяма трудност. Как да ги поставите впериодичната таблица? Те не могат да се считат за различни елементи, те всички са олово, но не могат да се считат за един елемент, един вид атоми - те имат различни атомни тегла.
В крайна сметка стана ясно, че всички те трябва да заемат едно място в периодичната таблица. Затова се наричат така - "изотопи" (от гръцките думи за "същото" и "място"). Освен това мистериозното несъответствие в хода на промяна на атомното тегло на двойките елементи аргон - калий, кобалт - никел, телур - йод остава необяснимо. Самият Менделеев бил принуден да ги подреди в таблицата, нарушавайки реда на нарастване на атомните им тегла: аргонът бил "по-тежък" от калия, кобалтът - никелът, телурът - йодът.
Този тест за периодичния закон беше много труден. Това постави под въпрос основата на периодичната система. Стана съвсем ясно, че атомното тегло не може да служи като величина, която определя химичните свойства на даден елемент. И науката отново беше изправена пред трудна задача.
Голямото откритие в науката, разбира се, никога не е внезапно. И преди Д. И. Менделеев много химици се опитваха да намерят общи модели и прилики в свойствата на химичните елементи. Например, немският учен J. Döbereiner установи още през 1829 г., че елементите с подобни химични свойства могат да бъдат групирани в три: да речем, литий, натрий и калий или хлор, бром и йод. Döbereiner нарича такива групи триади.
През 1849 г. българският химик Г. И. Хес се интересува от систематиката на елементите. В своя учебник „Основи на чистата химия“ той разглежда четири групи неметални елементи със сходни химични свойства: йод, бром, хлор, флуор, телур, селен, сяра, кислород, въглерод, бор, силиций, азот, фосфор, арсен. Хес пише: „Тази класификация все още е много далеч от естествената, новъпреки това комбинира елементи в групи, които са много сходни, и с разширяването на нашата информация може да се подобри.
Следващата стъпка е направена от френския химик Бежие дьо Шанкуртоа. Той си представя системата от елементи като спирална линия върху повърхността на цилиндър. Всеки ход има 16 елемента. Подобни елементи бяха разположени един под друг на генератора на цилиндъра. Но никой от учените не обърна внимание на работата на де Шанкуртоа. Английският химик Джон Нюландс през 1866 г. предлага така наречения закон на октавите. Той вярваше, че всичко в света е подчинено на общата хармония. И по химия, и по музика трябва да е така. Следователно свойствата на химичните елементи, подредени във възходяща атомна маса, трябва да се повтарят на всеки седем елемента, точно както в музикалната гама подобни ноти се редуват в октава на всеки седем ноти. Според закона на октавите обаче такива напълно различни елементи като въглерод и живак се оказаха сходни. Когато Нюландс докладва за работата си на среща на Лондонското химическо дружество, един от присъстващите, не без сарказъм, попита дали изтъкнатият оратор се е опитал да подреди елементите по азбучен ред и дали е открил някакъв модел в това.
По-близо от другите до истината беше може би немският химик Л. Майер. През 1868 г. той предлага таблица, в която всички известни химични елементи са разделени на шест групи според тяхната валентност. Но нито един от тези славни химици, които направиха много за изготвянето на периодичния закон, дори не подозираше, че има "празни места" в техните знания за природата на елементите, те не можаха да открият Великия закон. Оказа се, че само геният на Менделеев може да го направи.