катерици. Характеристики на обмяната на отделни аминокиселини, стр. 3
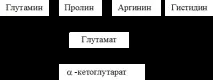
Основният член на семейството на а-кетоглутаровата киселина е глутаминовата киселина.
Глутаминовата киселина играе важна роля в междинния метаболизъм на няколко аминокиселини. Те включват глутамин, пролин, аргинин и хистидин.
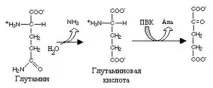
Превръщането на глутамин в глутаминова киселина наподобява превръщането на аспарагин в аспарагинова киселина и се катализира от глутаминаза. Като се има предвид, че глутаминът е основната транспортна форма на амоняка, глутаминазата играе важна роля в органите, които активно използват амоняк, предимно в черния дроб и бъбреците.
Аргининът и пролинът по пътя към глутаминовата киселина имат общ метаболит - глутамин g полумиалдехид
Пролин дехидрогеназата окислява пролиновата молекула, за да образува продукт (дехидропролин), който спонтанно се хидролизира по неензимен начин, за да образува глутамин полумиалдехид. Пътят до това съединение в аргинина започва с реакция, катализирана от аргиназа, а орнитинът, продуктът на тази реакция, след трансаминиране с a-кетоглутарат, също се превръща в глутамин полумиалдехид. Специфична дехидрогеназа на глутамин семиалдехид го окислява с образуването на глутаминова киселина.
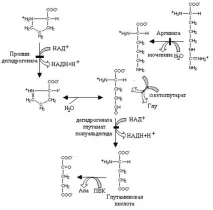
Глутаминовата киселина, която се образува от горните аминокиселини, се превръща в кетоглутарова киселина чрез реакция на трансаминиране.
Глутаматът, аспартатът и аланинът са най-взаимозаменяемите от взаимозаменяемите.
Глутаминовата киселина, аспарагиновата киселина и аланинът се образуват в едноетапна реакция от централните метаболити. Те са прости по структура и техният синтез също не е сложен.
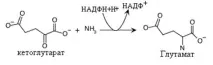
Синтез на глутаминова киселина.
Глутаминовата киселина се синтезира чрез добавяне на амоняк към a-кетоглутарат. Тази реакция насърчава усвояването на амоняка от клетките и използването му в синтеза на другиаминокиселини. Освен това самата глутаминова киселина се използва като субстрат при синтеза на някои аминокиселини. Реакцията се катализира от глутамат дехидрогеназа. Водородният донор в тази реакция е NADPH+H+. Реакцията на редукционно аминиране е обратна на окислителното дезаминиране, при което глутамат дехидрогеназата използва NAD+ като акцептор на водород. Тази специална връзка с коензимите придава на глутамат дехидрогеназата вид трансдехидрогеназни свойства, които свързват NAD + и NADP + зависимите процеси.
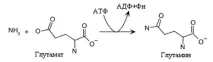
Образуването на глутамин е друга реакция, която осигурява усвояването на амоняка от клетката. Реакцията е екзергонична и използва АТФ за образуване на амидна връзка. Глутамин синтетазата, която катализира тази реакция, е алостеричен ензим с голям брой регулатори. Алостеричните инхибитори на глутамин синтетазата при бозайниците са глицин, аланин, серин, карбомоил фосфат и α-кетоглутарат като активатор. При микроорганизмите регулацията на активността на този ензим е още по-сложна. Глутаминът е основната транспортна форма на амоняка в кръвта и донор на аминогрупа при синтеза на много азотсъдържащи съединения.
Други прости реакции включват прехвърлянето на аминогрупа (трансаминиране) от глутамат или глутамин към централен метаболит за получаване на желаната аминокиселина. Аспарагиновата киселина се синтезира чрез прехвърляне на аминогрупа от глутамат към оксалоацетат.
. Синтез на аспарагинова киселина.
Тази реакция е прост пример за възможното използване на амоняк от клетките за синтез на аминокиселини, медииран от реакции на асимилиране на амоняк (реакция на глутамат дехидрогеназа).
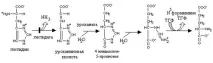
Образуването на аспарагин при бозайниците се различава от това на глутамин. Аспарагин синтетазата катализираенергийно зависим трансфер на аминогрупата на глутамин към аспарагинова киселина Това е придружено от по-дълбока хидролиза на АТФ В микроорганизмите и растенията механизмът на синтез на аспарагин е подобен на реакцията на глутамин синтетаза и протича с помощта на амоняк
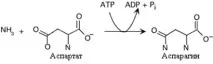
Образуването на аспарагин. Трябва да се отбележи използването на AMP вместо ADP в тази реакция.Това освобождава повече енергия, необходима за синтеза.
Механизмът на синтеза на аланин също се основава на трансаминиране. Тази реакция включва глутаминова (донор на аминогрупа) и пирогроздена (акцептор на аминогрупа) киселини. Микроорганизмите могат да използват валин вместо глутамат в тази реакция.
Нарушенията на пътищата за превръщане на аминокиселините в глутаминова киселина се проявяват по различни начини. При вроден дефицит на пролин дехидрогеназа се развива хиперпролинемия тип I, а при недостатъчност на глутамин полуалдехид дехидрогеназа се развива хиперпролинемия тип II. И двата вида вероятно се наследяват по автозомно-рецесивен начин и често са придружени от умствена изостаналост, но тези разстройства не се считат за животозастрашаващи. Степента на хиперпролинемия при тип II е по-висока, отколкото при хиперпролинемия тип I. При пациенти с хиперпролинемия тип II в урината се открива А'-пиролин-3-хидрокси-5-карбоксилат, продукт на разграждане на хидроксипролин.
Хипераргининемията се развива, когато има дефицит на аргиназа в черния дроб (вижте раздела за механизмите на образуване на урея).
- AltGTU 419
- AltGU 113
- AMPGU 296
- ASTU 266
- BITTU 794
- BSTU "Voenmekh" 1191
- BSMU 172
- BSTU 602
- BSU 153
- BSUIR 391
- БелГУТ 4908
- BSEU 962
- БНТУ 1070
- BTEU PK 689
- БрСУ 179
- ВНТУ 119
- VSUES426
- ВлГУ 645
- VMEDA 611
- ВолгГТУ 235
- ВНУ им. Далия 166
- VZFEI 245
- ВятГША 101
- ВятГГУ 139
- ВятГУ 559
- GGDSK 171
- GomGMK 501
- GSMU 1967
- GSTU im. Сухой 4467
- ГСУ им. Скарина 1590г
- GMA им. Макарова 300
- ГДПУ 159
- DalGAU 279
- DVGGU 134
- DVGMU 409
- DVGTU 936
- DVGUPS 305
- FEFU 949
- ДонГТУ 497
- DITM MNTU 109
- IVGMA 488
- IGHTU 130
- ИжГТУ 143
- KemGPPC 171
- KemGU 507
- KSMTU 269
- Киров АТ 147
- KGKSEP 407
- KGTA им. Дегтярев 174
- КнАГТУ 2909
- КрасГАУ 370
- КрасГМУ 630
- KSPU им. Астафиева 133
- KSTU (SFU) 567
- КГТЕИ (СФУ) 112
- PDA № 2 177
- КубГТУ 139
- КубСУ 107
- KuzGPA 182
- КузГТУ 789
- MSTU им. Носова 367
- МГУ ги. Сахарова 232
- IPEC 249
- МГПУ 165
- МАИ 144
- МАДИ 151
- MGIU 1179
- MGOU 121
- MGSU 330
- Московски държавен университет 273
- МГУКИ 101
- MGUPI 225
- MGUPS (MIIT) 636
- МГУТУ 122
- MTUCI 179
- ХАЙ 656
- TPU 454
- NRU MPEI 641
- НМСУ "Горни" 1701
- ХПИ 1534
- НТУУ "КПИ" 212
- НУК тях. Макарова 542
- HB 777
- NGAVT 362
- NSAU 411
- NGASU 817
- NGMU 665
- NGPU 214
- NSTU 4610
- НГУ 1992г
- NSUE 499
- NII 201
- OmGTU 301
- OmGUPS 230
- СПбПК №4 115
- PGUPS 2489
- ПСПУ им. Короленко 296
- ПНТУ им. Кондратюк 119
- RANEPA 186
- ROAT MIIT 608
- RTA 243
- RSHU 118
- РГПУ им. Херцен 124
- РГППУ 142
- RSSU 162
- "МАТИ" - РГТУ 121
- РГУНиГ 260
- REU ги. Плеханов 122
- РГАТУ им. Соловьова 219
- RyazGMU 125
- RGRTU 666
- SamGTU 130
- СПбГАСУ 318
- INGECON 328
- СПбГИПСР 136
- СПбГЛТУ им. Киров 227
- СПбГМТУ 143
- СПбГПМУ 147
- SPbGPU 1598
- СПбГТИ (ТУ) 292
- СПбГТУРП 235
- Държавен университет в Санкт Петербург 582
- GUAP 524
- СПбГУНИПТ 291
- СПбГУПТД 438
- СПбГУСЕ 226
- СПбГУТ 193
- СПГУТД 151
- SPbGUEF 145
- Електротехнически университет в Санкт Петербург "LETI" 380
- ПИМаш 247
- NRU ITMO 531
- СГТУ им. Гагарина 114
- СахСУ 278
- SZTU 484
- СибАГС 249
- СибГАУ 462
- СибГИУ 1655 г
- СибГТУ 946
- SGUPS 1513
- СибГУТИ 2083
- СибУПК 377
- SFU 2423
- SNAU 567
- SSU 768
- TRTU 149
- ТОГУ 551
- TGEU 325
- TSU (Томск) 276
- TSPU 181
- ТулГУ 553
- УкрГАЖТ 234
- UlGTU 536
- UIPCPRO 123
- USPU 195
- USTU-UPI 758
- UGNTU 570
- USTU 134
- ХГАЕП 138
- KhSAFC 110
- HNAGH 407
- HNUVD 512
- KhNU им. Каразина 305
- ХНУРЕ 324
- KhNEU 495
- Процесор 157
- ЧитГУ 220
- SUSU 306
За да отпечатате файла, изтеглете го (във формат Word).