Лекция №5 Кристализация
Кристализация. Структурата на слитъка
Всяко вещество, както е известно, може да бъде в три агрегатни състояния: газообразно, течно и твърдо. В металите и сплавите при определени температури настъпва и промяна в агрегатното състояние: твърдото състояние се заменя с течно състояние при точката на топене, течното състояние става газообразно при точката на кипене. Температурите на прехода зависят от налягането, но при постоянно налягане те са добре дефинирани. Температурата на топене за всеки метал е определена и е постоянна.
При прехода от течно към твърдо състояние се образува кристална решетка, появяват се кристали. Този процес се нарича кристализация.
Какво обяснява съществуването на течно състояние при едни температури и твърдо състояние при други температури и защо трансформацията се извършва при строго определени температури?
В природата всички спонтанно възникващи процеси или трансформации и следователно кристализация и топене се дължат на факта, че новото състояние при нови условия е енергийно по-стабилно, т.е. има по-малко енергия. (Всяка система в природата се стреми към минимум свободна енергия).
Енергийното състояние на системата се характеризира с термодинамична функция F, наречена свободна енергия (F=U - TS, където U е вътрешната енергия на системата или общата енергия, T е абсолютната температура, S е ентропията). От това следва, че колкото по-голяма е свободната енергия на системата, толкова по-малко стабилна е системата и ако има възможност, тогава системата преминава в състояние, в което свободната енергия е по-малка (както в примера с топката).
Промяната във външните условия, като температура, води до промяна в свободната енергия. Тезипромените протичат по сложен закон, като те са различни както за течно, така и за твърдо състояние. Въпреки това, тя може да бъде представена схематично, както следва:
Над температурата T o веществото в течно състояние има по-малко свободна енергия, под температурата T o - веществото в твърдо състояние.
Очевидно при температура, равна на T o , свободните енергии на течното и твърдото състояние са равни, металът и в двете състояния е в равновесие. Тази температура T o е равновесната или теоретичната температура на кристализация. Въпреки това, при T около процесите на кристализация или топене не могат да възникнат, т.к при дадена температура F W = F кр.
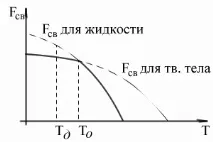
За да започне кристализация, е необходимо процесът да бъде термодинамично благоприятен за системата и да бъде придружен от намаляване на свободната енергия на системата. От графиката следва, че това е възможно само когато течността е охладена под точката T o. Температурата, при която практически започва кристализацията, се нарича действителна температура на кристализация.
Охлаждането на течност под равновесната температура на кристализация се нарича преохлаждане.
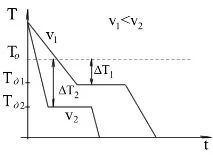
Обратната трансформация от кристално състояние в течност може да се случи, съответно, само над температурата T o, това явление се нарича прегряване.
Стойността или степента на преохлаждане е разликата между теоретичната и действителната температура на кристализация. (Пример: T pl - Mg - 651С, и T cr f - 615С, 651 - 615 = 36С).
Процесът на преминаване на метал от течно състояние в кристално състояние може да бъде представен чрез криви в координатите време - температура.
Охлаждането на метал в течно състояние е придружено от постепенно понижаване на температурата и може да се нарече просто охлаждане, т.к. докато няма качествопромени в състоянието.
При достигане на температурата на кристализация на кривата температура-време се появява хоризонтална платформа, т.к отделянето на топлина се компенсира от латентната топлина на кристализация, отделена по време на кристализацията. В края на кристализацията, т.е. след пълен преход в твърдо състояние, температурата започва да намалява отново и кристалното твърдо вещество се охлажда.
Механизмът на процеса на кристализация
Още през 1878 г. Д. К. Чернов, изучавайки структурата на лятата стомана, посочи, че процесът на кристализация се състои от два елементарни процеса. Първият процес е зараждането на най-малките кристални частици, които Чернов нарича "рудименти", а сега те се наричат ядра или центрове на кристализация. Вторият процес се състои в израстване на кристали от тези центрове.
Да приемем, че пет ядра се появяват в секунда на дадено място и растат с определена скорост. До края на първата секунда се образуваха пет ядра, до края на втората секунда те бяха нараснали и в същото време се появиха още пет нови ядра от бъдещи кристали. И така процесът продължава, докато цялата течност кристализира. Този процес може да бъде представен чрез кинетична крива. Разглеждането на такива схеми на кристализация позволява да се обяснят две важни точки:
С развитието на процеса на кристализация в него участват все повече и повече кристали. Следователно процесът на кристализация първоначално се ускорява, докато в един момент (обикновено, когато около 50% от течността е кристализирала), взаимният сблъсък на нарастващите кристали започва забележимо да възпрепятства растежа им; растежът на кристалите се забавя, особено след като течността, в която се образуват нови кристали, става все по-малко.
По време на процеса на кристализация, докато кристалът е заобиколен от течност,често има правилна форма, но когато кристалите се сблъскват и растат заедно, правилната им форма се нарушава, външната форма на кристала се оказва зависима от условията на контакт на нарастващите кристали. Ето защо металните кристали - зърна - нямат правилна форма.
Скоростта на целия процес на кристализация се определя качествено от две величини: скоростта на зараждане на центровете на кристализация и скоростта на растеж на кристалите.
И двете от тези количества могат да бъдат измерени за различни условия на кристализация.
h.c - броят на центровете за кристализация, възникнали в 1 mm 3 за 1 сек.
с.к. - е скоростта на нарастване на линейните размери на кристала mm/s.
Изследването на кристализацията показа, че Ch.C. и с.к. определя се от степента на хипотермия.
Зависимости на s.c. и гл. от хипотермия се изразяват с крива с максимум. При теоретичната температура T o (n = 0), стойностите на r.m.s. и гл. са равни на нула и процесът на кристализация не може да премине Fzh=Fcr.
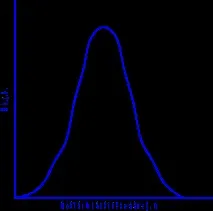
С увеличаване на преохлаждането средноквадратичната стойност и гл. увеличаване, достигане на максимум и след това намаляване. Намалена s.c. и гл. при високи степени на преохлаждане се дължи на факта, че при високи преохлаждания и следователно при ниски температури подвижността на атомите намалява, като по този начин намалява способността на системата да се трансформира. При високи степени на преохлаждане, с.к. и гл. стават равни на нула, т.к подвижността на атомите вече не е достатъчна за пренареждането им от хаотична подредба в течност към правилна подредба в кристал.
Размерът на образуваните кристалити зависи от съотношението на s.c. и гл. при температурата на кристализация, при дадена степен на преохлаждане. С голяма стойност на с.к. и малка стойност на c.c. (тази ситуация се развива в малки степенихипотермия - фигура), образуват се няколко големи кристала; за малки стойности на r.m.s. и големи c.c. (голямо преохлаждане) се образуват голям брой малки кристали. Ако е възможно течността да се преохлади много силно без кристализация, тогава s.c. и гл. стане равно на нула, течността остава нетрансформирана, некристализирала. Течните метали обаче са малко склонни към преохлаждане и не могат да достигнат такова състояние. Солите, силикатите, органичните вещества, напротив, са много склонни към хипотермия. Пример за това е стъклото, което е преохладена сгъстена течност. Такова състояние е аморфно, характеризира се с липса на определена точка на топене и липса на правилно подреждане на атомите под формата на специфична кристална решетка.
Като цяло процесът на кристализация може да продължи само при условие на намаляване на свободната енергия, следователно, ако се образува ядро с размер по-малък от Rcr, то не може да расте, т.к. това би довело до увеличаване на енергията на системата. Ако се образува ембрион с размер R cr или повече, тогава неговият растеж е възможен, т.к. това ще доведе до намаляване на свободната енергия. Минималният размер на зародиш, способен да расте, се нарича критичен размер на зародиша, а зародиш с този размер се нарича стабилен. Колкото по-висока е степента на преохлаждане, толкова по-малък е размерът на стабилното ядро.
При реални условия на кристализация степента на преохлаждане може да играе второстепенна роля, тъй като Има много други фактори, които влияят на този процес.
По време на кристализация от течно състояние, за скоростта на процеса и за формата на образуваните кристали, такива фактори като скоростта и посоката на отвеждане на топлината, наличието на неразтворени частици, коитомогат да служат като готови центрове на кристализация, наличието на конвекционни течения на течността и др. например, кристалът расте по-бързо в посоката на отвеждане на топлината, отколкото в другата посока.
Ако на страничната повърхност на нарастващ кристал (по някаква причина) се появи туберкул (потокът на гореща течност се е променил, неразтворена частица е заседнала), тогава кристалът придобива способността да расте в странична посока. В резултат на това се образува дървовиден кристал, т. нар. дендрит, чиято схематична структура е показана и описана за първи път от Д.К. Чернов. В свиващата кухина на 100-тонен стоманен слитък един от студентите на Чернов откри дендрит с дължина 39 см. Досега във всички учебници по металознание или материалознание този дендрит се показва и нарича "кристал на Чернов".
За първи път описание на стоманен слитък е дадено през 1878 г. от Д. К. Чернов. Основните характерни черти в структурата на лятия метал бяха отбелязани от Чернов, въпреки че многобройни последващи изследвания разкриха много нови подробности, въпреки това основните принципи останаха същите.
И така, структурата на излят слитък се състои от три основни зони. Първата зона е външната дребнозърнеста кора, състояща се от дезориентирани малки кристали - дендрити. При първия контакт със стените на формата в тънък съседен слой течен метал възниква рязък температурен градиент и явлението преохлаждане, което води до образуването на голям брой кристализационни центрове. В резултат на това кората получава финозърнеста структура.
Втората зона на слитъка е зоната на колонните кристали. След образуването на самата кора условията за отвеждане на топлината се променят (поради повишаване на температурата на стената на формата, намаляване на топлопреминаването, тъй като се появяват още две граници - твърдо - течно и твърдо - стената на формата и др.причини), температурният градиент в съседния слой течен метал рязко намалява и следователно степента на преохлаждане намалява. В резултат на това от малък брой центрове на кристализация започват да растат колоновидни кристали, нормално ориентирани към повърхността на кората (по посока на отвеждане на топлината).
Третата зона на слитъка е зоната на равноосните кристали. В центъра на слитъка вече няма определена посока на пренос на топлина. Поради това температурата се изравнява и кристалите растат в различни посоки, срещайки се един с друг. В резултат на това се образува равноосна структура.
Местоположението на последните две зони в слитъка е от голямо значение.
В зоната на колонните кристали металът е по-плътен, съдържа по-малко черупки и газови мехурчета. Въпреки това, ставите на колонните кристали имат ниска якост.
Кристализацията, водеща до свързване на зони на колонни кристали, се нарича транскристализация. Степента на развитие на колонните кристали ще варира главно в зависимост от химичния състав на метала, степента на неговото прегряване, размера на слитъка, скоростта на леене, формата и дебелината на формата и температурата на стените му. Това ще повлияе на скоростта на отделяне на топлина и образуването на по-големи или по-малки температурни градиенти в обема на стоманата.
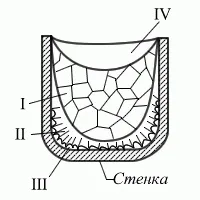
Течният метал има по-голям обем от кристализирания метал, така че металът, излят във формата, се свива по обем по време на кристализацията, което води до образуването на празнини, наречени кухини при свиване. Кухините за свиване могат да бъдат или концентрирани на едно място, или разпръснати в целия обем на слитъка или в част от него. Ето защо, за да може отлятият продукт да не съдържа такъв дефект като кухина на свиване, те прибягват до такъв технологичен метод като производствотопла глава - увеличаване на обема на формата, където ще бъде концентрирана кухината на свиване. Докато продуктът ще бъде без пори.