Методи за изготвяне на различни индикатори
Розолова киселина. Този индикатор се използва под формата на алкохолно-воден разтвор: 0,1 g розолова киселина се разтваря в 10 ml чист алкохол и след това се добавят 70 ml дестилирана вода.
Индикатор Andrede: фуксинова киселина 1 g, дестилирана вода 400 ml, разтвор на натриев хидроксид 64 ml. След приготвяне денят се държи в термостат, 2 дни на светло. Съхранява се в тъмна бутилка. Зачервява се в кисела среда.
Индикатори на Кларк. Приготвя се под формата на алкохолни и водни разтвори. При приготвянето на специални хранителни среди се използват алкохолни разтвори (1,6%). За определяне на реакцията се използват водни разтвори, тъй като те са по-чувствителни от алкохолните разтвори. За приготвяне на воден разтвор 0,1 g от индикатора на прах се смилат в хаванче с ахат с 1/20 N разтвор на натриев хидроксид. Различни индикатори се разтварят в различни количества натриев хидроксид: за фенолово червено са необходими 5,7 ml, за метилово червено - 7,4 ml, за крезолово червено - 5,3 ml, за бром-крезолово червено - 3,7 ml, за бромтимолово синьо - 3,2 ml, за тимолово синьо - 4,3 ml.
След разтварянето се добавя вода до 25 ml и се получават 0,4% основни разтвори, които се съхраняват за бъдеща употреба. За да се определи реакцията, основните разтвори се разреждат с дестилирана вода в съответствие с концентрацията на работния разтвор (0,04–0,02% и др.).
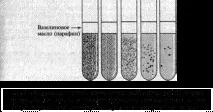
За да се определи пътя на разграждане на глюкозата (окислителен или ферментативен), се провежда тестOF (тест за окисление/ферментация): културата се инокулира в две епруветки с полутечен PS, съдържащ глюкоза и бромтимолово синьо. Към една от тях се добавя слой вазелиново масло (за създаване на анаеробиоза) и двете епруветки се инкубират при 37 °C. Образуването на киселина, придружено от пожълтяване на средата в двете епруветки, показва ензимна реакция.Образуването на киселина само в епруветка без масло показва използването на глюкоза чрез окисление. Липсата на образуване на киселина в двете епруветки показва, че тестваните микроорганизми не използват глюкозата по тези начини (вижте цветната вложка, Фиг. 9). В последните два случая микроорганизмите могат да бъдат класифицирани като "неферментиращи" видове -Acinetobacter, Alcaligenes, Burkholderia, Flavimonas, Flavobacterium, Pseudomonas и др.
За откриване на микробнанитрат редуктаза се провежда тест за редукция на нитрата до нитрит (последният, в присъствието на N,N-диметил-1 -нафтиламин, образува диазо съединение, което оцветява средата в червено). Културата се отглежда върху полутечна среда, съдържаща 0.1 % нитрат, и се добавя смес от посочения реагент със сулфанилова киселина, като се наблюдава в продължение на няколко минути развитието на червено оцветяване на средата (показателно за наличието на нитрит).
За да се определикаталаза, 0,5–1,0 ml 3% разтвор на водороден прекис се излива върху повърхността на 24-часова култура върху наклонен агар (кръвен агар не може да се използва, тъй като катализата на еритроцитите може да даде фалшиво положителна реакция). Появата на газови мехурчета се счита за положителна реакция. Като контрола трябва паралелно да се изследва култура, за която е известно, че съдържа каталаза.
Биохимичните свойства на голям брой култури от аеробни и анаеробни бактерии често се изследват с помощта на специалнимикротест системи имикробиологични анализатори. Като правило за това се използват полистиренови плаки с изолирани ямки, съдържащи изсушени среди за диференциална диагностика. При въвеждане на малко количество стандартизирана суспензия от тестваната чистакултура, средата в ямките се възстановява и по време на последваща инкубация в термостат, културата расте в ямките, показвайки характерните си промени в съответните среди.
Анализаторът се различава от мултимикротестовете по това, че отчитането, а в някои устройства и инокулацията и инкубацията се извършват автоматично (мътността и промените в цвета на средата във всяка ямка се записват с помощта на вграден спектрофотометър).
Антигенните свойствана изолираната култура обикновено се изследват с помощта на теста за аглутинация.
Вирулентносттасе определя чрез идентифициране на фактори на патогенност, чрез заразяване на експериментални животни, тъканни култури или в експериментални модели.
За да се определичувствителността към антимикробниагенти, културата се инокулира върху течна и твърда среда в съответствие с приетите методи за изследване.
Характерните свойства на бактериите, които са важни за тяхното идентифициране, са дадени в разделите за лабораторна диагностика на заболяванията, които причиняват.
В някои случаи се използва биологична проба за изолиране на чиста култура на патогена (чума, туларемия и др.).
използването на специални среди с редуциращи вещества - тиогликолова киселина, натриев тиогликолат, цистеин, глюкоза, парчета черен дроб (среда на Кит-Тароци) и мозъчна (среда на Хиблер) тъкан, месо и др .;
свързване или заместване на кислород в херметически затворени съдове - анаеростати, ексикатори или специални пластмасови торби (фиг. 1.7);
изолиране на анаероби в хранителната среда от въздействието на атмосферния кислород (засяване във висока колона в епруветка или епруветка, изливане на вазелиново масло върху повърхността на хранителната среда, методът на Перец и др.);
с помощта на специални анаеробни кутии (виж цветната вложка, фиг. 11).
На първия етап изследваният материал за натрупване на анаероби се засява в среда Kitt-Tarozzi (концентрирана
3*

MPB или бульон на Hottinger, глюкоза, 0,15% агар-агар, pH 7,2 - 7,4). На дъното на епруветката за адсорбция на кислород се поставят парчета варен черен дроб или мляно месо със слой 1,0–1,5 cm и се наливат 6–7 ml от средата. Преди сеитба средата трябва да се загрее във вряща водна баня за 10-20 минути (за да се отстрани разтвореният в нея кислород) и след това да се охлади. Когато се изолират спорови форми на анаероби, засятата среда отново се нагрява при температура 80 ° С в продължение на 20-30 минути, за да се унищожат неспоровите форми на бактериите. Културите се заливат с вазелиново масло и се поставят в термостат. Ева среда и др.
Например, тиогликоловата среда се състои от казеинов хидролизат - 15, екстракт от дрожди и / или месо - 5, глюкоза - 5,5, натриев хлорид - 2,5, L-цистеин и натриев тиогликолат - по 0,5, резазурин - 0,001, агар-агар - 0,75. Средата се излива в епруветки или флакони, стерилизира се при 121 °C за 15 минути и се съхранява на тъмно място. При зачервяване на горната част на колоната на средата повече от Uz, тя се възстановява чрез нагряване във вряща водна баня или в поток от пара.
На втория етап се отчитат промените, настъпили в акумулиращата среда, а именно появата на мътност или мътност и образуване на газ. Бульонната култура се събира с пипета на Пастьор, която се спуска през слой вазелиново масло до дъното на епруветката. Намазките се приготвят върху стъкло по обичайния начин, фиксират се в пламък и се оцветяват по Грам. На бележка за микроскопияморфологични характеристики на спорообразуващи и неспорообразуващи анаероби (например наличието на големи грам-положителни пръчки позволява да се подозира наличието на клостридии в материала). Повторното засяване от акумулиращата среда се извършва върху специални плътни хранителни среди за анаероби. Изолираните колонии обикновено се получават по един от двата метода, описани по-долу.
1.
2. Отглеждайте анаеробни микроорганизми в дълбините на плътна хранителна среда (метод на серийно разреждане на Weinberg). Културата от средата се взема с пастьорска пипета със запечатан край и се пренася последователно в 1-ва, 2-ра и 3-та епруветки с 10 ml ICN. След това продължават да правят разреждания в епруветки, изработени от тънко стъкло с диаметър 0,8 cm и височина 18 cm, прехвърляйки материала в 4-та, 5-та и 6-та епруветки със захарен агар, разтопен и охладен до 50 ° C или среда на Wilson-Blair. След втвърдяване на агара културите се поставят в термостат. За да се приготви средата на Wilson-Blair, 10 ml от 20% разтвор на натриев сулфит и 1 ml от 8% разтвор на железен хлорид се добавят към 100 ml разтопен MPA, съдържащ 1% глюкоза.
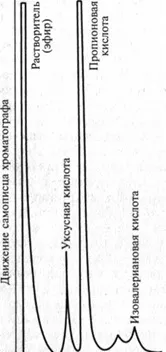
Фиг. 1.9. Хроматограма на проба, получена за идентифициране на анаероби по състав и количество на летливи мастни киселини
На третия етап се изследват изолираните колонии, образувани в чашите и се правят натривки от най-типичните . Останалата част от колонията се инокулира в средата Kitt-Ta- rozzi. От епруветки със захарен агар или среда на Wilson-Ble- ra, колониите се отстраняват със стерилна пипета на Пастьор или витал- агарната колона се кима с пара, докато се нагрява дъното на епруветката (фиг. 1.8).1 2 3 4 5 6 И 3 части от колонията приготвят петна иВреме, min остатъците й се засяват върху Kitt-Ta-
rozzi за натрупване на чиста култура и се инкубира при 37 °C. На четвъртия етап културата, отгледана върху средата Kitt-Tarots-qi, се проверява за чистота и се идентифицира чрез морфологични, културни, биохимични, антигенни и други свойства (виж по-горе). Понякога, за идентифициране на изолирани култури (или директно откриване на анаероби в тестовия материал), газово-течната хроматография определя характерните метаболити на анаеробното "дишане" - летливи мастни киселини (фиг. 1.9)
На петия етап се вземат предвид и анализират резултатите от изследването.